Sepanta Laser Spadan
شرکت سپنتا لیزر اسپادان سهامی خاصSepanta Laser Spadan
شرکت سپنتا لیزر اسپادان سهامی خاصمیکروسکوپ جذبی تشدید کننده فوتونیک
میکروسکوپ جذبی تشدید کننده فوتونیک
کریستال های فوتونیک تشدید کننده های نوری هستند که به طور گسترده برای میکروسکوپ با وضوح دیجیتال و سنجش زیستی مورد بررسی قرار می گیرند [42، 43]. بلورهای فوتونیک دارای آرایش تناوبی هستند که دارای گذردهی دی الکتریک هستند که به عنوان یک آنالوگ نوری برای پتانسیل اتمی الکترون ها عمل می کند [44]. طول موجهای تشدید با دستکاری میدانهای الکترومغناطیسی مرتبط با نور ساطع شده از کریستالهای فوتونیک تولید میشوند. به این ترتیب، یک موج ایستاده الکترومغناطیسی که شدت های نسبت به شدت منبع نور روشن کننده را نشان می دهد تولید می شود [45-47]. علاوه بر این، نشان داده شده است که نانوذرات طلا (AuNP) با رزونانس پلاسمون سطح موضعی (LSPR) با میدان الکترومغناطیسی تشدید کننده یک کریستال فوتونی همپوشانی دارند، که منجر به تقویت قابل توجه راندمان جذب میشود [48]. این ترکیبی از نانوذرات طلا و سطح بلورهای فوتونیک، مشاهده تک تک نانوذرات طلا را با میکروسکوپ نوری معکوس معمولی امکان پذیر می کند. در این روش، جذب نانوذرات افزایش یافته، نوری را که به درون هدف میکروسکوپ منعکس میشود، کاهش میدهد. میکروسکوپ جذبی تشدید کننده فوتونیک نوعی میکروسکوپ حسگر زیستی است که از جفت تشدید کریستال های فوتونی-AuNP استفاده می کند [49-51]. همانطور که توسط Canady و همکارانش اشاره شد، شدت نور منعکس شده از بلورهای فوتونی در حضور هر نانوذره زمانی که طول موج تشدید پلاسمون سطحی نانوذره با طول موج تشدید بلور فوتونی مطابقت داشته باشد، به صورت موضعی خاموش می شود [49]. آنها حساسیت فوق العاده (<1 بعد از ظهر) و همچنین انتخاب عدم تطابق تک پایه و حد تشخیص 100-aM را از طریق سنجش تمایز جنبشی نشان دادند [49]. چن و همکاران استفاده از یک رویکرد وضوح زیر میکرونی بدون برچسب به نام میکروسکوپ افزایشیافته کریستال فوتونی را مورد مطالعه قرار دادند که از سطح حسگر زیستی کریستال فوتونی به عنوان بستری برای اتصال سلولی برای درک اتصال و مورفولوژی سلولهای بنیادی دندانی موش استفاده میکند. مطالعه مرور زمان شامل کموتاکسی با یک شیمیکشنده در شکل 4 نشان داده شده است [46]. ژائو و همکاران استفاده از یک بیوسنسور نوری کریستال فوتونی پوشش داده شده با پروتئین نوترکیب سنبله را برای تشخیص کمی سطح IgG سرولوژیکی انسان در برابر ویروس SARS-CoV-2 مطالعه کردند. این رویکرد تک مرحلهای و بدون شستشو از نانوذرات طلای عاملدار شده با آنتیبادی استفاده میکند که مجتمعهای ایمنی ساندویچی را تشکیل میدهند. رویکردی به نام «کنترل فعال + شمارش دیجیتال» (AC + DC) تشخیص 100 pg mL-1 از COVID-19 IgG انسانی را در نمونههای سرم در طی یک سنجش 15 دقیقهای امکانپذیر کرد [50]. Ghosh و همکارانش استفاده از میکروسکوپ جذبی تشدید کننده فوتونی را با روشنایی از یک نور پلاریزه که از یک LED قرمز با شدت کم ساطع میشود و تشخیص با یک سنسور تصویر CMOS ارزان قیمت برای مراقبتهای زیستی ارزان قیمت توصیف کردند. آنها تشخیص توالی های miRNA را با محدودیت تشخیص 160 صبح با زمان سنجش 30 دقیقه نشان دادند [52].
توموگرافی کامپیوتری با گسیل تک فوتون
توموگرافی کامپیوتری با گسیل تک فوتون
با پیشرفت در تشخیص مولکولی و رادیولوژیکی، توموگرافی کامپیوتری گسیل تک فوتون (SPECT) یکی از تکنیک های تصویربرداری قدرتمند برای بررسی جریان خون به بافت ها و اندام ها در نظر گرفته می شود. این یک تکنیک تصویربرداری هسته ای است که توموگرافی کامپیوتری و استفاده از ردیاب های رادیواکتیو را ترکیب می کند. دومی به تشخیص جریان خون به اندام ها برای تشخیص عفونت ها، تومورها، تشنج و سایر شرایط پزشکی کمک می کند [32]. به طور معمول، فلوئور-18، ید-123، تالیم-201 و زنون-133 ایزوتوپ های رادیویی مورد استفاده در این تکنیک هستند. داس و همکاران نشان دادند که توموگرافی کامپیوتری با انتشار تک فوتون پرفیوژن (Q) در تشخیص آمبولی ریه در یک گروه شش نفره از بیماران مبتلا به عفونت SARS-CoV-2 مفید بود [31]. Vöö و Dizdarevic اشاره کردند که ادغام SPECT با توموگرافی کامپیوتری با دوز پایین برای تشخیص حوادث ترومبوآمبولیک وریدی در بیماران COVID-19 مفید است. فقط پرفیوژن SPECT ممکن است در بیماران حامله COVID-19 استفاده شود [33]. Cobes و همکاران نشان دادند که SPECT با توموگرافی کامپیوتری با دوز پایین ممکن است برای تشخیص آمبولی ریه در بیماران تحت درمان پنومونی COVID-19 از طریق مشاهده ناهنجاریها در تهویه و پرفیوژن استفاده شود [34].
تبدیل فوریه طیف سنجی مادون قرمز
تبدیل فوریه طیف سنجی مادون قرمز
استفاده از طیفسنجی مادون قرمز برای تشخیص بیماری COVID-19 نسبتاً جدید است. تلاشهایی برای جفت کردن ابزارهای طیفسنجی با مدلهای هوش مصنوعی به منظور شناسایی ویروس SARS-CoV-2 انجام شده است. کیتان و همکاران روشی را برای شناسایی SARS-CoV-2 با استفاده از نمونههای RNA استخراجشده با ترکیب تکنیکهای FTIR و یادگیری ماشین (ML) توسعه داد. نمونه های نازوفارنکس جمع آوری شده از 280 بیمار برای استخراج RNA پردازش شدند. دامنه های طیفی FTIR که در 600-1350 cm-1 قرار دارند. 1500-1700 cm-1؛ و 2300-3900 cm-1 به اثر انگشت RNA نسبت داده شد [20]. مشتقات طیف خام بهدستآمده برای عادیسازی دادههای طیف تبدیلشده استفاده شد. الگوریتم های یادگیری ماشین برای ساخت مدل های طبقه بندی استفاده شد. تعداد زیادی نمونه و تکنیکهای طبقهبندی پراکنده برای بهبود ویژگی، حساسیت و دقت تجزیه و تحلیل دادهها و همچنین برای افزایش قابلیت تفسیر مدلها استفاده شد. این رویکرد پس از استخراج RNA تنها چند دقیقه زمان آزمایش میبرد و در عین حال ویروس SARS-CoV-2 را با حساسیت 97 درصد، دقت 97.8 درصد و ویژگی 98.3 درصد تشخیص میدهد. در مطالعه دیگری، ژانگ و همکاران از تکنیک تشخیص ATR-FTIR برای تشخیص بیماری COVID-19 در نمونه های سرم 3 میکرولیتری استفاده کردند. تجزیه و تحلیل ترکیبی طیفسنجی و آماری برای نمونههای مثبت COVID-19 و نمونههای کنترل انجام شد. تجزیه و تحلیل جزئی حداقل مربعات متمایز (PLS-DA) به تمایز سویه ویروسی SARS CoV-2 از التهاب یا سایر عفونتهای ویروسی تنفسی کمک کرد. این رویکرد یک ناحیه زیر منحنی مشخصه عملکرد گیرنده (AUROC) مقدار 0.956 [21] را ارائه کرد. به طور مشابه، Banerjee و همکاران روش اکتساب ATR-FTIR را به ترتیب با مدل های تجزیه و تحلیل تفکیک حداقل مربعات جزئی (PLS-DA) به کار بردند. در نظر گرفتن طیف ATR-FTIR و پارامترهای بالینی (به عنوان مثال، جنس، سن، وضعیت فشار خون بالا و وضعیت دیابت) باعث افزایش سطح زیر منحنی ROC (AUC) شد، که نشان میدهد این پارامتر چقدر خوب میتواند بین بیمار و نرمال تشخیص دهد. هم برای داده های آموزشی و هم برای داده های آزمون. مجموعه آزمون مستقل 94.1٪ حساسیت و 69.2٪ ویژگی به دست آورد. نمونه هایی از بیماران دیابتی، منطقه FTIR 1020-1090 cm-1 و FTIR منطقه 1588-1592 cm-1 قوی ترین پیش بینی کننده ها بودند [22]. گولکن و همکاران تشخیص بیماری کووید-19 را در سرم خون زنان علامت دار و بدون علامت و باردار مورد مطالعه قرار دادند. نمونه های زنان باردار مبتلا به بیماری کووید-19 و زنان باردار سالم مورد مقایسه قرار گرفتند [23]. نمونه ها با استفاده از FTIR آنالیز شدند. تغییرات اوج با رویکردهای یادگیری ماشین چند متغیره (به عنوان مثال، یک الگوریتم جنگل تصادفی، یک الگوریتم درخت تصمیم تک C5.0، و یک شبکه عصبی عمیق) تجزیه و تحلیل شد. سطوح بیوشیمیایی، سطح سلولهای خون محیطی و پارامترهای انعقادی برای زنان باردار در شکل 2 نشان داده شده است. دقتی بیش از 90 درصد با استفاده از این رویکرد نشان داده شد [23].
طیف سنجی جذب مادون قرمز با سطح افزایش یافته است
تکنیک های طیف سنجی مولکولی
روشهای جدید فوتونیک برای تشخیص عفونت SARS-CoV-2
توسعه یک رویکرد قابل اعتماد، سریع و کم هزینه با افزایش حساسیت برای تشخیص ویروس SARS-CoV-2 و بیماری COVID-19 یک اولویت مهم جامعه علمی است. این بررسی مروری بر رویکردهای فوتونیکی ارائه می دهد که برای تشخیص عفونت SARS-CoV-2 و بیماری COVID-19 در حال بررسی هستند.
رشته های پزشکی که از فوتونیک و اپتیک سود می برند
رشتههای پزشکی تخصصی که از پیشرفتهای اپتیک و بیوفوتونیک بهره میبرند، شامل جراحی مغز و اعصاب، جراحی آندوسکوپی، تصویربرداری پزشکی، قلب و عروق و داروسازی میشود، اما محدود به آن نمیشود.
تشخیص غیر تهاجمی
تکنیک های تشخیصی غیر تهاجمی به روش های تشخیصی اطلاق می شود که متکی به شکستن پوست بیمار نیست. بسیاری از تکنیکهای اپتیک، مانند اشعه ایکس، میتوانند برای عبور از بافت یا قرار دادن دوربینها برای تشخیص از جمله آندوسکوپی و دوربینهای بلع استفاده شوند.
لیزرها
لیزرهای پزشکی در جراحی چشم، دندانپزشکی و رفع سرطان استفاده می شود. لیزر همچنین ابزار بسیار مهمی در درمان های پوست و زیبایی پوست است.
توالی یابی ژنومی
با استفاده از نشانگرهای فلورسنت که به پایگاه های DNA خاصی متصل می شوند، می توان از لیزر برای شناسایی نشانگرها و انجام توالی یابی ژنومی استفاده کرد. این دانش از ساختار ژنتیکی بدن ما به پیشرفت های دارویی جدید و درمان های بهتر بیماری کمک می کند.
تصویربرداری زیست پزشکی
تصویربرداری زیست پزشکی از اولین استفاده از تصاویر اشعه ایکس در اواخر قرن نوزدهم راه طولانی را پیموده است. تصویربرداری پزشکی مدرن هنوز به شدت به اشعه ایکس متکی است، اما پیشرفتهای دیگر شامل فلوروسکوپی، تصویربرداری تشدید مغناطیسی (MRI)، توموگرافی محوری کامپیوتری (CAT یا CT اسکن)، توموگرافی انتشار پوزیترون (PET) و رادیوگرافی پروجکشن، و همچنین استفاده از تکنیک ها و تجهیزات میکروسکوپی پیشرفته مانند میکروسکوپ های نیروی اتمی.
پیشرفته بیواپتیک و بیوفوتونیک
لبه برش های بیواپتیک و بیوفتونیک شامل استفاده از میکروسکوپ های نیروی اتمی برای دستکاری مستقیم غشای سلولی، دستکاری لیزری پروتئین ها و تکنیک های تصویربرداری پیشرفته مانند OCT (توموگرافی انسجام نوری) و CT (توموگرافی کامپیوتری) است.
درمان های فعال شده با نور
درمانهای فعالشده با نور از نور برای تشویق فرآیندهایی مانند بهبود زخم یا درمان سرطانها از طریق درمان فوتودینامیک استفاده میکنند.
استفاده از فناوری بیوفوتونیک در کاربردهای بهداشتی
اپتیک و فوتونیک سابقه قوی در تحقیقات پزشکی و تشخیص دارند. از اولین اشکال میکروسکوپ، کاربردهای پزشکی به محصولات و تکنیک های مدرن مانند درمان های لیزری، طیف سنجی، میکروسکوپ مدرن، تصویربرداری با وضوح بالا و حتی تشخیص از راه دور با استفاده از ارتباطات فیبر نوری ادامه یافته است.
ابزار تشخیصی جدید تصویربرداری تومورها را در طول جراحی سرطان مغز روشن می کند
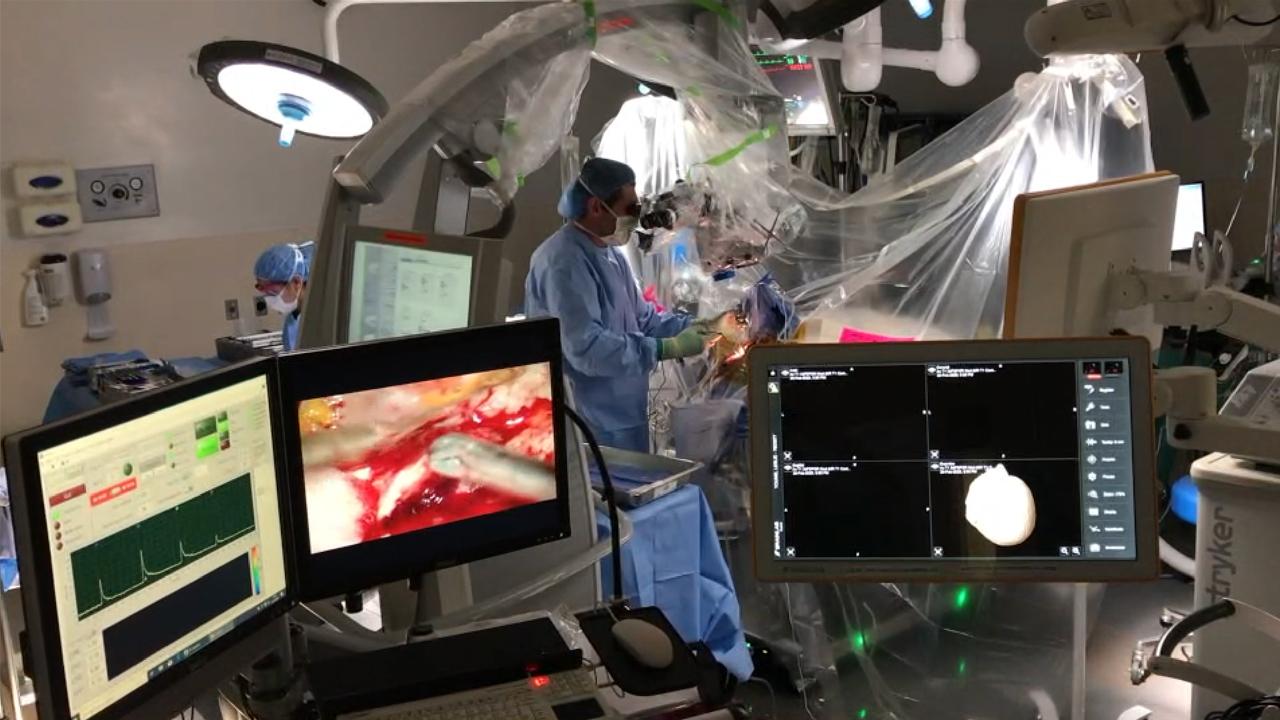
یک فناوری جدید تصویربرداری نوری که در دانشگاه کالیفرنیا، دیویس توسعه یافته است، می تواند به جراحان مغز و اعصاب کمک کند تا به صورت بصری و عینی بین بافت های سالم و سرطانی در طول جراحی های سرطان مغز تمایز قائل شوند. این فناوری که تصویربرداری مادام العمر فلورسانس (FLIm) نام دارد، می تواند به جراحان اجازه دهد تا تومورهای بدخیم را به طور دقیق تر و کامل تر حذف کنند.
فناوری های تصویربرداری در طی جراحی های سرطان مغز
در طول جراحی های سرطان مغز، جراحان مغز و اعصاب باید بافت های بدخیم در هم تنیده با مغز نرمال و عملکردی را شناسایی و حذف کنند. برای تشخیص خوب از بد، جراحان از فناوری های تصویربرداری کمکی از MRI های بزرگ و گران قیمت حین عمل گرفته تا ابزارهای تصویربرداری مبتنی بر رنگ میکروسکوپی استفاده می کنند.
این ابزارهای تصویربرداری تجاری موجود عموماً در تشخیص تومورهای کمتر تهاجمی کارایی پایینی دارند. آنها نیاز به برنامه ریزی قابل توجه قبل از جراحی، راه اندازی اتاق عمل ویژه و تجویز رنگ های بالقوه سمی به بیماران دارند.
FLIm چیست و چگونه کار می کند؟
جراح با یک کاوشگر تشخیصی قلم مانند دستی که با فناوری FLIm کار می کند، بافت ها را برای تغییرات فلورسنت مربوط به تغییرات در متابولیسم بافت اسکن می کند، عاملی که به شدت با تومورهای سرطانی مغز مرتبط است.
دستگاه FLIm نور ذاتی ساطع شده از بافت ها را گرفته و آنالیز می کند. این داده های بصری و کمی را با اندازه گیری های دقیق نور اتوفلورسانس ساطع شده از بافت ها فراهم می کند. این نور نشان دهنده وجود یا عدم وجود ناهنجاری های متابولیک و در نتیجه خطر سلول های سرطانی است.
بلوخ، جراح مغز و اعصاب و یک رهبر شناخته شده بین المللی در سرطان مغز، گفت: «اگر جراحان بتوانند تغییرات متابولیک در بافت را در طول عمل شناسایی و تجسم کنند، می توانند دقیقاً بافت های سرطانی را برداشته و بقای بیماران خود را بهبود بخشند.
FLIm استانداردهای مراقبت را برای جراحی های سرطان مغز تغییر می دهد؟
ویژگی دستگاه FLIm جمع آوری و نمایش داده ها ساده، سریع و انعطاف پذیر است. این امکان ادغام یکپارچه با تکنیک های تصویربرداری موجود در جراحی مغز و اعصاب را فراهم می کند. این یک جایگزین بسیار ارزان تر برای MRI و یک ابزار تشخیصی راحت تر و ایمن تر از تصویربرداری مبتنی بر رنگ است.
مارکو، پروفسور مهندسی بیوپزشکی، گفت: "مزیت کلیدی تکنیک FLIm ما این است که می تواند نفوذ تومور را در زمان واقعی در طول جراحی مغز و اعصاب بدون نیاز به مواد حاجب برجسته کند." ما از ویژگیهای فلورسانس ذاتی بافت مغز برای تشخیص مناطقی که تومور به مغز سالم نفوذ میکند، استفاده میکنیم.»
کاربرد FLIm در جراحی های سرطان مغز هنوز در مرحله نمونه اولیه است. در صورت تایید، انتظار می رود که جراحی های مغز و اعصاب را متحول کند.
تست و اعتبارسنجی FLIm
در مرحله اول مطالعه، محققان در حال جمعآوری دادههای ثبت FLIm در حین جراحی و مقایسه آنها با نتایج بیوپسی بافت هستند. این مرحله برای ایجاد دقت خواندن FLIM و ایجاد دستورالعمل هایی برای تفسیر داده ها ضروری است.
ما در حال ساخت مجموعه داده های آموزشی خود هستیم که بر اساس آن می توانیم معیارهای خاصی را ایجاد کنیم که می تواند بافت تومور را از بافت سالم متمایز کند. بلوخ گفت: ما قدرت پیشبینی این دستورالعملها را در مرحله دوم مطالعه تأیید خواهیم کرد.
در مرحله دوم، محققان از این فناوری برای هدایت حذف تومورهای مغزی استفاده خواهند کرد. آنها میزان بهبود حذف تومور و بقای بیمار را تعیین خواهند کرد.
بلوچ افزود: «ما معتقدیم که استفاده از FLIm در جراحیهای سرطان مغز باعث پیشرفت این زمینه و بهبود شانس بقا برای بیماران مبتلا به سرطان مغز میشود». این فناوری بومی دانشگاه کالیفرنیا دیویس ممکن است به استاندارد بعدی مراقبت تبدیل شود که به طور گسترده در جراحی های سرطان پذیرفته شده است.
مهندسی زیست پزشکی جراحی مغز و اعصاب
مهندسی زیست پزشکی جراحی مغز و اعصاب
طیفسنجی و تکنیکهای تصویربرداری طول عمر فلورسانس، تشخیص نوری بافت بیولوژیکی، کاربردهای بالینی فناوریهای بیوفوتونیکی، شناسایی اپتیکی بدون برچسب مواد زیستی
تحقیق و مهندسی ابزار دقیق مبتنی بر طول عمر فلورسانس و سیستمهای تصویربرداری چندوجهی که مطالعات تغییرات مولکولی، متابولیکی و مورفولوژیکی در سیستمهای زنده را از سلولهای بیولوژیکی و مدلهای حیوانی گرفته تا بیماران انسانی را امکانپذیر میسازد. تحقیقات او کاربردهای منحصربهفردی را که بر مدیریت بالینی بیماریهای حیاتی انسانی تأثیر میگذارد، با تأکید بر سه حوزه متمایز هدف میگیرد: سیستمهای قلبی عروقی (تشخیص داخل عروقی)، انکولوژی (تشخیص حاشیههای جراحی حین عمل) و پزشکی احیاکننده (مهندسی بافت).