Sepanta Laser Spadan
شرکت سپنتا لیزر اسپادان سهامی خاصSepanta Laser Spadan
شرکت سپنتا لیزر اسپادان سهامی خاصنوآوری های فوتونیک برای علوم زیستی
علم و فناوری تراهرتز
تکنولوژی نیمه هادی
کاربردهای زیست پزشکی
مجله بیوفوتونیک
مجله بیوفتونیک
محدوده
مجله بیوفوتونیک اولین مجله بینالمللی است که به انتشار مقالات و نقدهای اصلی از حوزه هیجانانگیز بیوفوتونیک، یعنی توسعه و کاربرد فناوریهای فوتونیک بهویژه برای (زیست) پزشکی، و همچنین علوم زیستی و محیطی اختصاص دارد. این مجله بستری را ارائه می دهد که توسعه دهندگان فناوری (فیزیکدانان، شیمیدانان، مهندسان، و غیره) با استفاده کنندگان نهایی (به ویژه پزشکان تحقیقاتی) ارتباط برقرار می کنند و در آن پزشک بالینی در مورد آخرین ابزارهای تشخیص و درمان بیماری ها می آموزد. به این ترتیب، این مجله بسیار میان رشته ای است و پژوهش های نوآورانه ای را در زمینه تعامل نور با مواد بیولوژیکی منتشر می کند. این پوشش از تحقیقات بنیادی تا پیشرفتهای خاص را شامل میشود، در حالی که شامل آخرین برنامهها یا کارآزماییهای بالینی/گزارشهای موردی نیز میشود.
موضوعات
زمینه های کاربرد:
دارو
سلامتی
زیست شناسی
محیط زیست و تغذیه
فناوری های ویژه:
میکروسکوپی / تصویربرداری / آندوسکوپی
(به عنوان مثال میکروسکوپ عمومی، تصویربرداری فلورسانس، میکروسکوپ ارتعاشی، توموگرافی انسجام نوری، تصویربرداری فوتوآکوستیک، میکروسکوپ میدان نزدیک و غیره)
طیف سنجی
(IR، رامان، اپتیک منتشر، فلورسانس، لومینسانس، THz، UV/Vis، پراکندگی نور و غیره)
رویکردهای درمانی فوتونیک
(PDT، جراحی لیزر، LIBS، انعقاد عکس و غیره)
نقطه مراقبت فوتونیک
(بیوچیپ، سنجش زیستی، فناوری میکرو آرایه و غیره)
هوش مصنوعی
(به عنوان مثال تجزیه و تحلیل تصویر، پردازش تصویر، شیمی سنجی و غیره)
پیشرفت در طیفسنجی فیبر نوری رامان بلادرنگ برای تشخیص زودهنگام سرطان: فشار دادن مرز به برنامههای آندوسکوپی بالینی
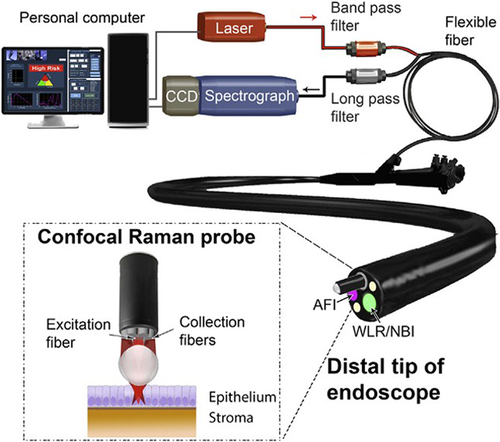
آندوسکوپهای انعطافپذیر [1] بر اساس بازتاب نور سفید (WLR) استاندارد مراقبت برای تشخیص سرطان و نظارت بر پیش سرطان در اندامهای داخلی است [2]. با این حال، یک چالش بالینی در تشخیص ضایعات پیش بدخیم و تغییرات اولیه نئوپلاستیک نهفته است. تکیه بر معیارهای تشخیصی بصری ذهنی (یعنی جزئیات ساختاری و مورفولوژیکی بافت) منجر به دقت تشخیصی ضعیف به دلیل فقدان تغییرات مورفولوژیکی آشکار مرتبط با دگرگونی نئوپلاستیک اولیه، حتی در دستان آندوسکوپیست های مجرب می شود [3]. تصویربرداری اتوفلورسانس (AFI) [4-6] و تصویربرداری باند باریک (NBI) [6، 7] برای بهبود تشخیص سرطان با مشاهده فلوروفورهای درون زا در بافت و افزایش کنتراست تصویر ریز عروقی بافت ایجاد شدهاند، اما این میدان وسیع است. روشهای تصویربرداری هنوز از ویژگیهای تشخیصی متوسطی به دلیل وابستگی بین مشاهدهگر و عدم توانایی آشکارسازی اطلاعات بیومولکولی خاص در مورد بافت رنج میبرند. توسعه فنآوریهای نوری پیشرفته کمتهاجمی یا غیرتهاجمی مبتنی بر امضاهای زیست مولکولی ذاتی سلولها و بافتها، سنگ بنای تشخیص آندوسکوپی است. نمونهبرداریهای نوری هدفمند برای کاوش بافت پرخطر در محل میتواند تا حد زیادی خطاهای نمونهبرداری تصادفی بیوپسی و همچنین هزینههای مراقبتهای بهداشتی و بار بیماران را کاهش دهد.
طیفسنجی رامان یک تکنیک ارتعاشی نوری منحصر به فرد است که قادر به بررسی ساختارهای مولکولی خاص و ترکیبات بافتی است و فرصتهای جدیدی برای تشخیص زودهنگام پیش سرطان و سرطان در انسان ایجاد میکند. فیزیکدان هندی سر چاندراساخارا ونکاتا رامان (1888-1970) با الهام از رنگ آبی عمیق دریای مدیترانه در طول سفر دریایی به اروپا در سال 1921 و کشف اثر کامپتون [8] (جایزه نوبل 1927)، "رامان" را کشف کرد. اثر» (1928) [9]، و متعاقباً جایزه نوبل فیزیک را در سال 1930 دریافت کرد. هنگامی که فوتون های فرودی باعث تغییر قطبش در یک مولکول می شوند، بخش کوچکی از فوتون های فرودی (~1 در 10 [8]) پراکنده می شوند. تغییر در فرکانس [10]. انرژی جذب شده مربوط به حالتهای ارتعاشی فعال رامان مولکولها است، و نور پراکنده شده، اثرانگشت (FP) منحصربهفردی از مولکولها را در نمونهها حمل میکند. با استفاده از لیزرهای مادون قرمز نزدیک (NIR) به عنوان منابع نور تحریک، طیفسنجی رامان NIR دارای مزایای قابل توجهی در کاربردهای زیست پزشکی است، زیرا آب در محدوده طول موج کاری NIR جذب بسیار پایینی دارد و بافتها اتوفلورسانس (AF) بسیار کمتری نسبت به استفاده کوتاهتر نشان میدهند. تحریک نور مرئی [11]. جذب آب کمتر به دلیل نفوذ عمیق نور به بافت، تشخیص اجزای بافت را آسان می کند. مطالعات اولیه به طور گسترده از طیفسنجی تبدیل فوریه رامان تحت تحریک NIR برای توصیف نمونههای بافتی مختلف، مانند بافتهای زنان [12]، مغزها [13، 14]، شریانها [15، 16]، پوست [17-20] بافت دهان [21] استفاده کردهاند. ] و غیره. با این حال، زمانهای طولانی اکتساب (حداکثر 10-35 دقیقه)، و تنظیمات نوری حجیم طراحیهای اولیه سیستم رامان، موانعی برای تشخیص پزشکی معمول در داخل بدن بودند. پیشرفتهای فنی اخیر در لیزرهای دیود فشرده NIR، طیفنگارهای تصویربرداری رامان با کارایی بالا با گریتینگهای هولوگرافی، دوربین دستگاه همراه با شارژ عمیق (CCD)، فیلترهای بریدگی/فیلترهای رامان با لبههای تیز و طرحهای مینیاتوری پروب رامان فیبر نوری کسب سریع طیف های رامان بافت NIR در محیط های بالینی را مجاز کرده اند [22-24]. شواهد انباشتهای از طیفسنجی رامان NIR برای شناسایی و تشخیص بافت در تعدادی از مکانهای اندام (مانند پوست [25-28]، پستان [29-31]، حفره دهان [32]، حنجره/نازوفارنکس [33-36] گزارش شده است. ]، مری و معده [37-41]، کولون [37، 42]، ریه [11، 43، 44]، مثانه [45-51]، پروستات [37، 49، 52]، دهانه رحم [53، 54]، مغز [48، 55-58]، استخوان [59، 60]، شریان [61، 62] و غیره). با تشویق نتایج امیدوارکننده مطالعات ex vivo Raman و همچنین آخرین پیشرفت در فنآوریهای NIR Raman، پیشرفت قابل توجهی در ترجمه طیفسنجی NIR Raman به کاربردهای آندوسکوپی in vivo در زمان واقعی حاصل شده است. در حال حاضر، شواهد رو به رشد قابل توجهی وجود دارد که نشان می دهد طیف سنجی رامان فیبر نوری دارای قابلیت تشخیص سریع و مشخص کردن بافت ها در داخل بدن، به روشی بدون برچسب و غیر مخرب است. این مقاله ابزار دقیق رامان بالینی پیشرفته، پیشرفتها در پروبهای آندوسکوپی رامان فیبر نوری، پیش پردازش طیفی، استخراج ویژگیهای پیشرفته و الگوریتمهای طبقهبندی مورد استفاده در طیف رامان برای تشخیص زودهنگام بیماری را بررسی میکند. دو دهه گذشته کار آندوسکوپی رامان خلاصه میشود، پیشرفتهای اخیر در هوش مصنوعی و یادگیری ماشین در طیفسنجی رامان زیستپزشکی برجسته میشود، و یافتههای زیستپزشکی از آخرین مطالعات بالینی in vivo نیز برای نشان دادن پتانسیل بزرگ مورد تاکید قرار میگیرد.
پیشرفت در طیفسنجی فیبر نوری رامان بلادرنگ برای تشخیص زودهنگام سرطان: فشار دادن مرز به برنامههای آندوسکوپی بالینی

ابزار دقیق رامان مدرن برای اندازه گیری و تشخیص رامان بالینی در زمان واقعی و in vivo. سیستم رامان شامل یک کاوشگر فیبر نوری با تفکیک عمق است که میتواند در کانال ابزار یک آندوسکوپ پزشکی قرار گیرد، یک طیفسنج حساس رامان که میتواند هم اثر انگشت و هم اطلاعات طیفی با تعداد موج بالا را بهطور همزمان به دست آورد، و یک الگوریتم یادگیری ماشینی قوی برای ارائه تشخیص دقیق رامان در زمان واقعی در آندوسکوپی.
توموگرافی انسجام نوری برای طبقه بندی بافت حنجره در یک محیط سرپایی - یک چالش ترجمه در آستانه حل؟
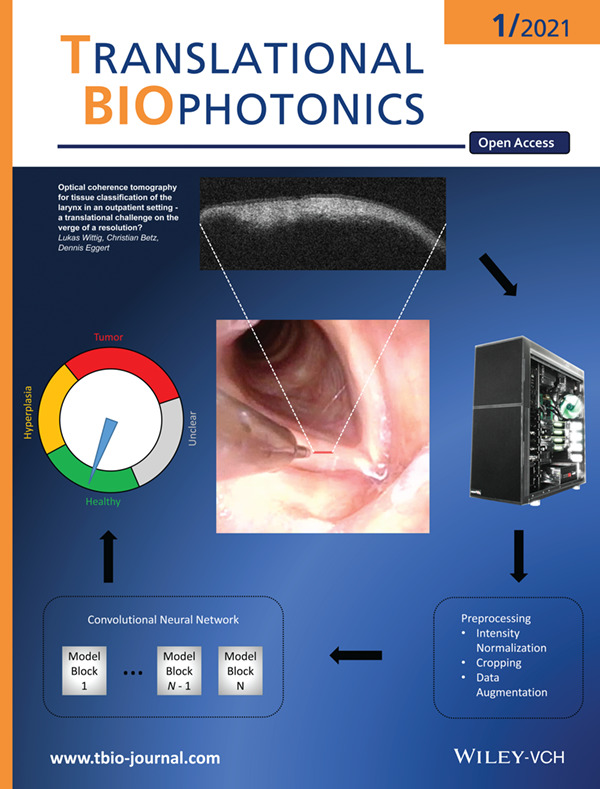
بیوپسی نوری سرطان حنجره توسط توموگرافی همدوسی نوری هدایت شده آندوسکوپی (OCT) همراه با روش های یادگیری عمیق: یک تصویر OCT یا ویدیو ابتدا از قبل پردازش شده و سپس با تکنیک های یادگیری عمیق مانند شبکه های عصبی کانولوشنال تجزیه و تحلیل می شود. خروجی نهایی می تواند بافت را به گروه های مختلفی طبقه بندی کند که از تصمیم پزشک حمایت می کند.
شناخت ویروس ها و عفونت های ویروسی با روش های بیوفتونیک
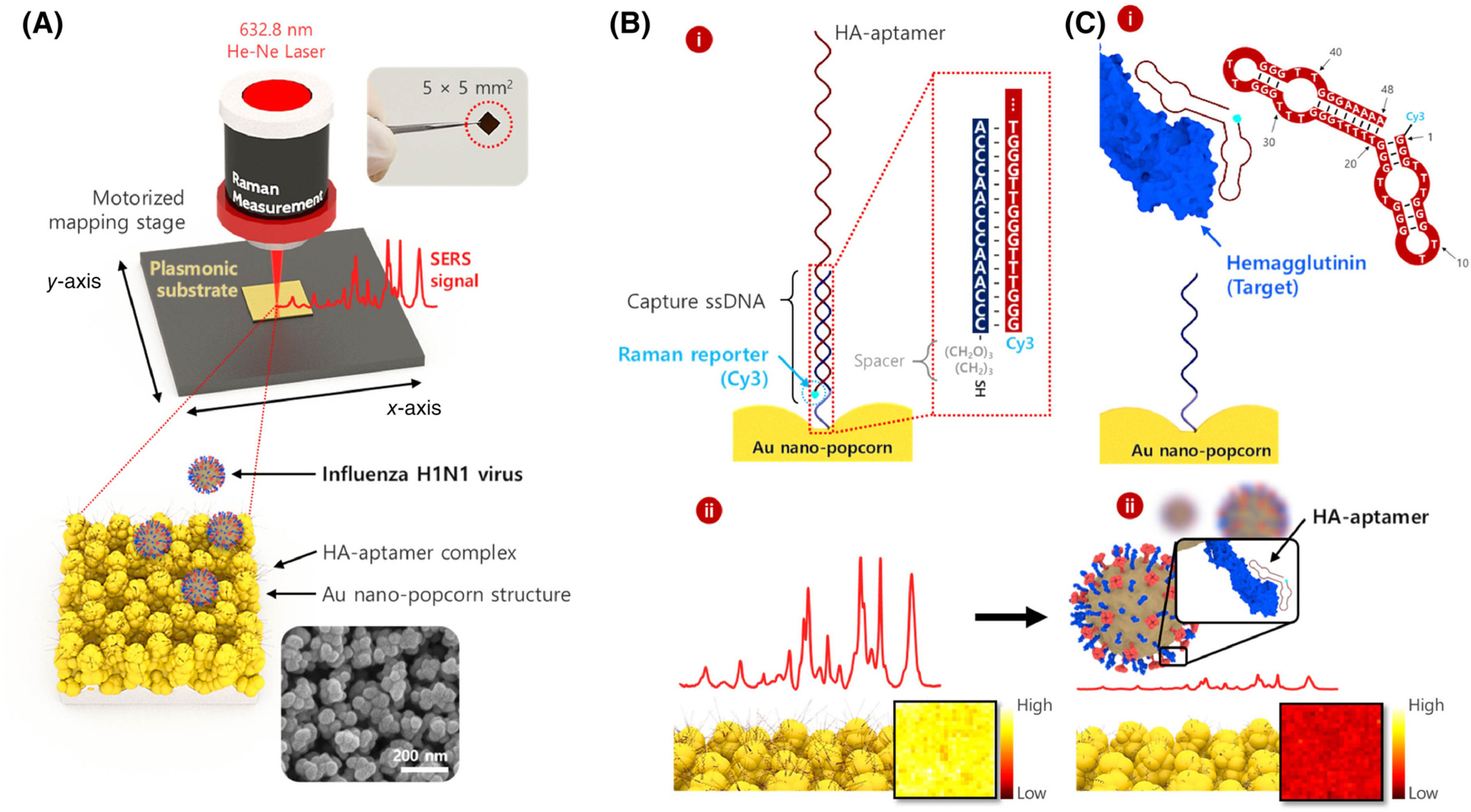
(الف) نمودار شماتیک تصویربرداری و طیفسنجی فتوترمال فروسرخ میانی تداخل سنجی هم کانونی (MIP)، (B) تصویر پراکندگی تداخل سنجی یک ویروس آبله منفرد، تصویر MIP از همان ویروس آبله در (C) 1550 cm-1 و (D) در 1650 cm-1، (E) به طور مثال طیف MIP از چهار ویروس آبله مختلف.
شناخت ویروس ها و عفونت های ویروسی با روش های بیوفتونیک
خلاصه
در چند دهه اخیر، شیوع عفونتهای ویروسی اغلب زیرساختهای بهداشتی در سراسر جهان را به چالش کشیده و علیرغم پیشرفت در فناوریهای تشخیصی، بار مالی قابلتوجهی و همچنین رنج انسانی را به همراه داشته است. شیوع اخیر ویروس ابولا در قاره آفریقا، ویروس زیکا در قاره آمریکا، سندرم حاد تنفسی (SARS)، سندرم تنفسی خاورمیانه (MERS)، آنفولانزای A و اخیراً سندرم حاد تنفسی ویروس کرونا 2 (SARS-CoV) -2) عفونت های ویروسی بارها و بارها اهمیت پیشرفت تکنولوژی را برجسته کرده اند که درک بهتر ویریون ها را ممکن می سازد. در این بررسی، ما به طور سیستماتیک جنبههای مختلف ویریونها و چگونگی بررسی خواص و عملکردهای آنها را با استفاده از فناوریهای مختلف مبتنی بر نور مورد بحث قرار میدهیم. ما بر طبقه بندی ویریون، تشخیص و تعامل با سیستم ایمنی میزبان تمرکز می کنیم. علاوه بر این، پتانسیل روشهای بیوفتونیک پیشرفته، به عنوان مثال، رامان، بازتاب مادون قرمز، طیفسنجی جذب و فلورسانس، تکنیکهای میکروسکوپی پیشرفته و رویکردهای مبتنی بر حسگر زیستی برای تشخیص عفونتهای ویروسی، بررسی درمانها و توسعه واکسن شرح داده شده است. اگرچه پیشرفتهای قابل توجهی قبلاً در فناوریهای فوتونیک انجام شده است، که حتی امکان تجسم تعاملات ویریون-میزبان را در سطح تک سلولی فراهم میکند، تکامل مداوم ویروسها نیازمند پیشرفت بیشتر در راهحلهای بیوفوتونی برای دستگاههای نظارت بر سلامت سریع، مقرونبهصرفه و قوی برای غربالگری عفونتهای ویروسی است.