Sepanta Laser Spadan
شرکت سپنتا لیزر اسپادان سهامی خاصSepanta Laser Spadan
شرکت سپنتا لیزر اسپادان سهامی خاصروش لکه لیزری جریان خون را در ریز عروق ثبت می کند

محققان دانشگاه ملی سنگاپور یک روش خودهمبستگی لکه های لیزری هم کانونی برای تصویربرداری از جریان پویا در عروق ریز ابداع کردند. این تکنیک بدون برچسب است و تصویربرداری کمی و بیدرنگ از جریان خون در سطح میکروسکوپی را امکانپذیر میکند.
این سیستم دارای بسیاری از ویژگی های یک میکروسکوپ فلورسانس کانفوکال است. مانند میکروسکوپ فلورسانس کانفوکال، می تواند تصاویر جریان با کیفیت بالا و با جزئیات را از نمونه های بافت ضخیم به دست آورد. روش توصیف شده توسط محققان نیازی به برچسب زدن فلورسانس یا هر روش آماده سازی نمونه دیگری ندارد. در عوض، مکانیسم کنتراست ذاتی است، بر اساس تغییرات فاز نوری ناشی از جریان سلولهای خون، که میتواند به نوسانات شدت نور تصادفی تبدیل شود.
هنگامی که یک نمونه بافت با پرتو لیزر روشن می شود، تصاویر به دست آمده به طور کلی دارای نوسانات شدت تصادفی هستند، به اصطلاح لکه های لیزری. راهاندازی تصویربرداری لکهای لیزری کانفوکال در بالای یک میکروسکوپ کانفوکال اسکن خطی اجرا میشود که یک خط روشنایی را روی نمونه تشکیل میدهد. یک دوربین خطی برای گرفتن انتخابی سیگنالهای لکهای که از خط روشن میآیند و به طور مؤثر نور خارج از فوکوس را رد میکند، قرار داده شده است، که یک مشکل جدی است که منجر به کاهش کنتراست و وضوح در تکنیکهای معمولی تصویربرداری لکههای لیزری میشود.
با اسکن سریع خط روشنایی در سراسر سطح نمونه، می توان تصاویر دوبعدی لکه های خام را با سرعت بیش از 200 فریم در ثانیه به دست آورد. تجزیه و تحلیل سری زمانی تصاویر لکه ای پیکسل به پیکسل انجام می شود - استراتژی که وضوح فضایی را در تصاویر پردازش شده حفظ می کند.
همبستگی خودکار و محاسبه کنتراست لکه هر دو حالت های رایج تجزیه و تحلیل هستند که پارامترهای مشتق شده از لکه را به سرعت جریان خون محلی مرتبط می کنند.
با این حال، ترکیب میکروسکوپ کانفوکال با تجزیه و تحلیل لکههای مبتنی بر همبستگی خودکار، به نام تصویربرداری خودهمبستگی لکهای لیزری اسکن خطی (LSAI)، مزایای قابلتوجهی دارد. آزمایشهای تصویربرداری با حیوانات کوچک، محققان را قادر ساخت تا نشان دهند که LSAI میتواند سرعت جریان محلی را در پیکسلهای منفرد، که بهطور قابلتوجهی کوچکتر از قطر معمولی مویرگها هستند، کمی کند. علاوه بر این، LSAI به اندازه کافی سریع است تا تغییرات سرعت جریان ویدئویی را در همان سطح میکروسکوپی ثبت کند.
یک کاربرد فوری و مهم تصویربرداری لکهدار لیزری کانفوکال، نقشهبرداری و تعیین کمیت جریان خون پویا در رگهای کوچک است که کوچکترین رگهای خونی در بافتهای اندام، از جمله شریانهای انتهایی، متارتریولها، مویرگها و ونولها هستند. تجزیه و تحلیل گردش خون در ریز عروق یا میکروسیرکولاسیون، در تجزیه و تحلیل و درک پاتوفیزیولوژی و پاتوژنز طیف گسترده ای از بیماری های انسانی اساسی است.
ابزارهای آزمایشی با وضوح زمانی و تفکیک مکانی به اندازه کافی بالا برای تجسم درون تنی و مهمتر از آن، اندازهگیری کمی نقشههای جریان خون وابسته به زمان در عروق کوچک برای تحقیقات بالینی و بالینی بیشتر مطلوب هستند.
محققان بر این باورند که این دستگاه می تواند به یک ابزار تصویربرداری استاندارد در تحقیقات میکروسیرکولاسیون و همچنین برای تشخیص بالینی تبدیل شود.
پیشرفت در طیفسنجی فیبر نوری رامان بلادرنگ برای تشخیص زودهنگام سرطان: فشار دادن مرز به برنامههای آندوسکوپی بالینی
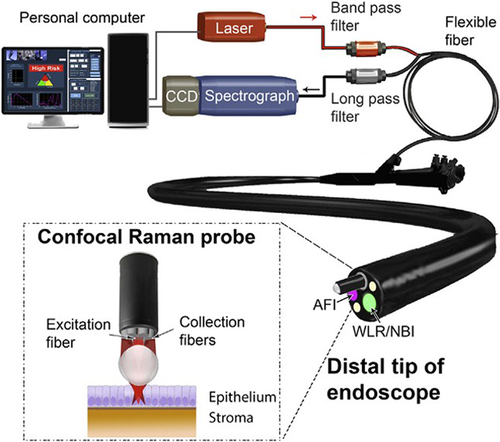
آندوسکوپهای انعطافپذیر [1] بر اساس بازتاب نور سفید (WLR) استاندارد مراقبت برای تشخیص سرطان و نظارت بر پیش سرطان در اندامهای داخلی است [2]. با این حال، یک چالش بالینی در تشخیص ضایعات پیش بدخیم و تغییرات اولیه نئوپلاستیک نهفته است. تکیه بر معیارهای تشخیصی بصری ذهنی (یعنی جزئیات ساختاری و مورفولوژیکی بافت) منجر به دقت تشخیصی ضعیف به دلیل فقدان تغییرات مورفولوژیکی آشکار مرتبط با دگرگونی نئوپلاستیک اولیه، حتی در دستان آندوسکوپیست های مجرب می شود [3]. تصویربرداری اتوفلورسانس (AFI) [4-6] و تصویربرداری باند باریک (NBI) [6، 7] برای بهبود تشخیص سرطان با مشاهده فلوروفورهای درون زا در بافت و افزایش کنتراست تصویر ریز عروقی بافت ایجاد شدهاند، اما این میدان وسیع است. روشهای تصویربرداری هنوز از ویژگیهای تشخیصی متوسطی به دلیل وابستگی بین مشاهدهگر و عدم توانایی آشکارسازی اطلاعات بیومولکولی خاص در مورد بافت رنج میبرند. توسعه فنآوریهای نوری پیشرفته کمتهاجمی یا غیرتهاجمی مبتنی بر امضاهای زیست مولکولی ذاتی سلولها و بافتها، سنگ بنای تشخیص آندوسکوپی است. نمونهبرداریهای نوری هدفمند برای کاوش بافت پرخطر در محل میتواند تا حد زیادی خطاهای نمونهبرداری تصادفی بیوپسی و همچنین هزینههای مراقبتهای بهداشتی و بار بیماران را کاهش دهد.
طیفسنجی رامان یک تکنیک ارتعاشی نوری منحصر به فرد است که قادر به بررسی ساختارهای مولکولی خاص و ترکیبات بافتی است و فرصتهای جدیدی برای تشخیص زودهنگام پیش سرطان و سرطان در انسان ایجاد میکند. فیزیکدان هندی سر چاندراساخارا ونکاتا رامان (1888-1970) با الهام از رنگ آبی عمیق دریای مدیترانه در طول سفر دریایی به اروپا در سال 1921 و کشف اثر کامپتون [8] (جایزه نوبل 1927)، "رامان" را کشف کرد. اثر» (1928) [9]، و متعاقباً جایزه نوبل فیزیک را در سال 1930 دریافت کرد. هنگامی که فوتون های فرودی باعث تغییر قطبش در یک مولکول می شوند، بخش کوچکی از فوتون های فرودی (~1 در 10 [8]) پراکنده می شوند. تغییر در فرکانس [10]. انرژی جذب شده مربوط به حالتهای ارتعاشی فعال رامان مولکولها است، و نور پراکنده شده، اثرانگشت (FP) منحصربهفردی از مولکولها را در نمونهها حمل میکند. با استفاده از لیزرهای مادون قرمز نزدیک (NIR) به عنوان منابع نور تحریک، طیفسنجی رامان NIR دارای مزایای قابل توجهی در کاربردهای زیست پزشکی است، زیرا آب در محدوده طول موج کاری NIR جذب بسیار پایینی دارد و بافتها اتوفلورسانس (AF) بسیار کمتری نسبت به استفاده کوتاهتر نشان میدهند. تحریک نور مرئی [11]. جذب آب کمتر به دلیل نفوذ عمیق نور به بافت، تشخیص اجزای بافت را آسان می کند. مطالعات اولیه به طور گسترده از طیفسنجی تبدیل فوریه رامان تحت تحریک NIR برای توصیف نمونههای بافتی مختلف، مانند بافتهای زنان [12]، مغزها [13، 14]، شریانها [15، 16]، پوست [17-20] بافت دهان [21] استفاده کردهاند. ] و غیره. با این حال، زمانهای طولانی اکتساب (حداکثر 10-35 دقیقه)، و تنظیمات نوری حجیم طراحیهای اولیه سیستم رامان، موانعی برای تشخیص پزشکی معمول در داخل بدن بودند. پیشرفتهای فنی اخیر در لیزرهای دیود فشرده NIR، طیفنگارهای تصویربرداری رامان با کارایی بالا با گریتینگهای هولوگرافی، دوربین دستگاه همراه با شارژ عمیق (CCD)، فیلترهای بریدگی/فیلترهای رامان با لبههای تیز و طرحهای مینیاتوری پروب رامان فیبر نوری کسب سریع طیف های رامان بافت NIR در محیط های بالینی را مجاز کرده اند [22-24]. شواهد انباشتهای از طیفسنجی رامان NIR برای شناسایی و تشخیص بافت در تعدادی از مکانهای اندام (مانند پوست [25-28]، پستان [29-31]، حفره دهان [32]، حنجره/نازوفارنکس [33-36] گزارش شده است. ]، مری و معده [37-41]، کولون [37، 42]، ریه [11، 43، 44]، مثانه [45-51]، پروستات [37، 49، 52]، دهانه رحم [53، 54]، مغز [48، 55-58]، استخوان [59، 60]، شریان [61، 62] و غیره). با تشویق نتایج امیدوارکننده مطالعات ex vivo Raman و همچنین آخرین پیشرفت در فنآوریهای NIR Raman، پیشرفت قابل توجهی در ترجمه طیفسنجی NIR Raman به کاربردهای آندوسکوپی in vivo در زمان واقعی حاصل شده است. در حال حاضر، شواهد رو به رشد قابل توجهی وجود دارد که نشان می دهد طیف سنجی رامان فیبر نوری دارای قابلیت تشخیص سریع و مشخص کردن بافت ها در داخل بدن، به روشی بدون برچسب و غیر مخرب است. این مقاله ابزار دقیق رامان بالینی پیشرفته، پیشرفتها در پروبهای آندوسکوپی رامان فیبر نوری، پیش پردازش طیفی، استخراج ویژگیهای پیشرفته و الگوریتمهای طبقهبندی مورد استفاده در طیف رامان برای تشخیص زودهنگام بیماری را بررسی میکند. دو دهه گذشته کار آندوسکوپی رامان خلاصه میشود، پیشرفتهای اخیر در هوش مصنوعی و یادگیری ماشین در طیفسنجی رامان زیستپزشکی برجسته میشود، و یافتههای زیستپزشکی از آخرین مطالعات بالینی in vivo نیز برای نشان دادن پتانسیل بزرگ مورد تاکید قرار میگیرد.
توموگرافی کامپیوتری با گسیل تک فوتون
توموگرافی کامپیوتری با گسیل تک فوتون
با پیشرفت در تشخیص مولکولی و رادیولوژیکی، توموگرافی کامپیوتری گسیل تک فوتون (SPECT) یکی از تکنیک های تصویربرداری قدرتمند برای بررسی جریان خون به بافت ها و اندام ها در نظر گرفته می شود. این یک تکنیک تصویربرداری هسته ای است که توموگرافی کامپیوتری و استفاده از ردیاب های رادیواکتیو را ترکیب می کند. دومی به تشخیص جریان خون به اندام ها برای تشخیص عفونت ها، تومورها، تشنج و سایر شرایط پزشکی کمک می کند [32]. به طور معمول، فلوئور-18، ید-123، تالیم-201 و زنون-133 ایزوتوپ های رادیویی مورد استفاده در این تکنیک هستند. داس و همکاران نشان دادند که توموگرافی کامپیوتری با انتشار تک فوتون پرفیوژن (Q) در تشخیص آمبولی ریه در یک گروه شش نفره از بیماران مبتلا به عفونت SARS-CoV-2 مفید بود [31]. Vöö و Dizdarevic اشاره کردند که ادغام SPECT با توموگرافی کامپیوتری با دوز پایین برای تشخیص حوادث ترومبوآمبولیک وریدی در بیماران COVID-19 مفید است. فقط پرفیوژن SPECT ممکن است در بیماران حامله COVID-19 استفاده شود [33]. Cobes و همکاران نشان دادند که SPECT با توموگرافی کامپیوتری با دوز پایین ممکن است برای تشخیص آمبولی ریه در بیماران تحت درمان پنومونی COVID-19 از طریق مشاهده ناهنجاریها در تهویه و پرفیوژن استفاده شود [34].
تصویربرداری رزونانس مغناطیسی
تصویربرداری اولتراسونیک
3. تصویربرداری اولتراسونیک.
3.1 اصول کلی تصویربرداری اولتراسونیک.
3.2 انتشار موج و امپدانس آکوستیک مشخصه.
3.3 بازتاب و شکست موج.
3.4 مکانیسم های از دست دادن انرژی در بافت.
3.5 ابزار دقیق.
3.6 حالت های اسکن تشخیصی.
3.7 مصنوعات در تصویربرداری اولتراسونیک.
3.8 ویژگی های تصویر.
3.9 تصویربرداری مرکب.
3.10 اندازه گیری سرعت خون با استفاده از اولتراسوند.
3.11 عوامل کنتراست اولتراسوند، تصویربرداری هارمونیک، و تکنیک های وارونگی پالس.
3.12 ایمنی و اثرات زیستی در تصویربرداری اولتراسونیک.
3.13 کاربردهای بالینی اولتراسوند.
اطلس آندوسکوپی دستگاه گوارش
مری
معده
اثنی عشر و آمپول
آندوسکوپی کپسولی
بیماری التهابی روده
کولون و ایلئوم
متفرقه و ...
نحوه تولید و تشخیص سونوگرافی
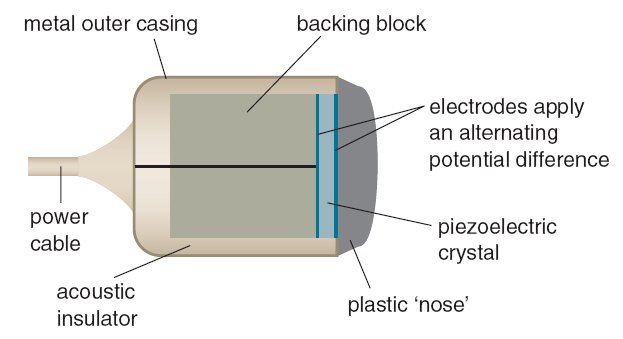
سونوگرافی با استفاده از مبدل اولتراسوند تولید و شناسایی می شود. مبدل های اولتراسوند قادر به ارسال سونوگرافی هستند و سپس همان مبدل می تواند صدا را تشخیص داده و آن را به سیگنال الکتریکی برای تشخیص تبدیل کند.
برای تولید اولتراسوند، یک کریستال پیزوالکتریک دارای جریان متناوب در سراسر آن است. کریستال پیزوالکتریک بسته به ولتاژی که از آن عبور می کند رشد می کند و منقبض می شود. عبور یک جریان متناوب از طریق آن باعث می شود که با سرعت بالایی ارتعاش کند و سونوگرافی تولید کند. این تبدیل انرژی الکتریکی به انرژی مکانیکی به عنوان اثر پیزوالکتریک شناخته می شود. سپس صدا از جسم مورد بررسی باز می گردد. صدا به کریستال پیزوالکتریک برخورد می کند و سپس اثر معکوس دارد - باعث می شود انرژی مکانیکی تولید شده از صدای ارتعاش کریستال به انرژی الکتریکی تبدیل شود. با اندازه گیری زمان بین ارسال و دریافت صدا، دامنه صدا و زیر و بمی صدا، کامپیوتر می تواند تصاویر تولید کند، عمق ها را محاسبه کند و سرعت ها را محاسبه کند.
فرکانس های مورد استفاده در تشخیص اولتراسوند
فرکانس های مورد استفاده در تشخیص اولتراسوند
سونوگرافی از صداهایی با فرکانس بالا استفاده می کند که بالاتر از آن چیزی است که گوش انسان می تواند بشنود. یعنی 20000 هرتز اولتراسوند نمی تواند اجسامی را که کوچکتر از طول موج خود هستند تشخیص دهد و بنابراین فرکانس های بالاتر اولتراسوند وضوح بهتری ایجاد می کند. از طرفی فرکانس های بالاتر اولتراسوند طول موج کوتاهی دارند و به راحتی جذب می شوند و بنابراین نافذ نیستند. به همین دلیل از فرکانسهای بالا برای اسکن نواحی نزدیک به سطح بدن و فرکانسهای پایین برای نواحی عمیقتر بدن استفاده میشود. این فرکانس ها عموما بین 1 تا 50 مگاهرتز هستند.
سونوگرافی در تشخیص پزشکی
خواص امواج اولتراسوند
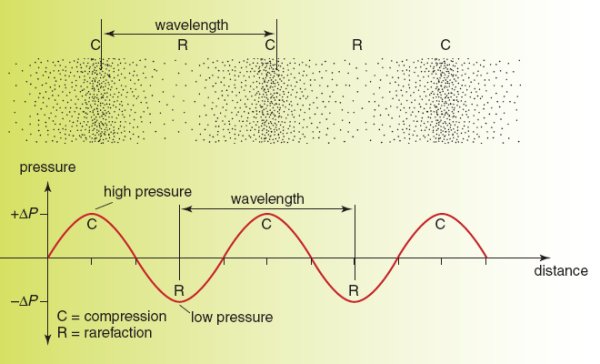
سونوگرافی برای تصویربرداری از بدن و تشخیص بیماران بر صداهای با فرکانس بالا متکی است. بنابراین سونوگرافی ها امواج طولی هستند که باعث می شوند ذرات به سمت جلو و عقب نوسان کنند و مجموعه ای از فشردگی ها و نادری ایجاد کنند.
با استفاده از فرمول زیر می توان سرعت، فرکانس یا طول موج یک موج را در صورت مشخص بودن دو مقدار دیگر محاسبه کرد:
v = fλ
جایی که:
سرعت (v) سرعت موج است. در m s-1 اندازه گیری می شود.
فرکانس (f) تعداد دفعاتی است که یک ذره در هر ثانیه نوسان می کند. بر حسب هرتز اندازه گیری می شود.
طول موج (λ) فاصله بین دو فشرده سازی یا نادری است. در متر اندازه گیری می شود.
دامنه فاصله ای است که یک ذره به جلو یا عقب حرکت می کند.
فشرده سازی مناطقی از موج است که ذرات به هم نزدیک هستند و فشار بالایی وجود دارد. نادر مناطقی از موج هستند که ذرات از هم دور هستند و فشار کم وجود دارد.