Sepanta Laser Spadan
شرکت سپنتا لیزر اسپادان سهامی خاصSepanta Laser Spadan
شرکت سپنتا لیزر اسپادان سهامی خاصکاربردهای پزشکی آندوسکوپ و لیزر
موارد استفاده از آندوسکوپ
پنج روش پزشکی که با استفاده از آندوسکوپ انجام می شود:
آرتروسکوپی
آندوسکوپ از طریق یک برش در پوست نزدیک مفصل تحت بررسی وارد می شود. این را می توان برای بررسی مفصل و عملیات پیش ساخته مانند برداشتن بافت های پاره شده استفاده کرد.
برونکوسکوپی
آندوسکوپ از طریق لولههای برونش در داخل ریهها وارد میشود تا به راه هوایی نگاه کند و هر گونه اشیایی که راه هوایی را مسدود کرده است را از بین ببرد.
بیوپسی آندوسکوپ
آندوسکوپ از طریق یک برش یا سوراخ در بدن وارد می شود که به ناحیه تحت بررسی منتهی می شود. سپس از فورسپس بیوپسی برای نمونه برداری از بافت استفاده می شود که می تواند توسط آسیب شناس آنالیز شود.
گاستروسکوپی (همچنین به نام اوزوفاگوگاسترودئودنوسکوپی)
آندوسکوپ در داخل گلو قرار می گیرد تا مشکلات مری، معده و دوازدهه مانند خونریزی یا زخم را بررسی کند.
لاپاراسکوپی
آندوسکوپ از طریق یک برش در شکم به منظور مشاهده اندام های شکمی و انجام جراحی جزئی وارد می شود.
قسمت های آندوسکوپ
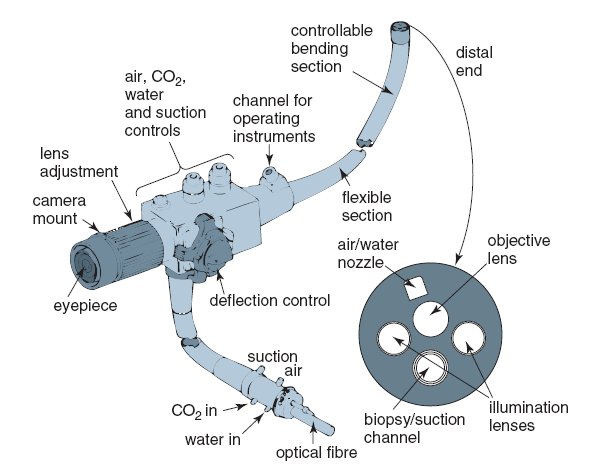
شفت
شفت فقط 10 میلی متر قطر دارد و می تواند تا 2 متر طول داشته باشد. انعطاف پذیر است و از فولاد و پلاستیک پوشانده شده است تا آن را ضد آب کند، از آسیب های شیمیایی جلوگیری کند و مانور آن را در بدن آسان کند. این شامل موارد زیر است:
بسته های فیبر نوری
نور توسط بستههای فیبر نوری غیر منسجم به ناحیه مورد بررسی هدایت میشود (بستههایی که فیبرهای نوری در دو انتها ردیف نشدهاند). با این حال، تصویر باید توسط یک بسته فیبر نوری منسجم (بسته ای که در آن فیبرهای نوری در دو انتهای فیبر ردیف شده اند به طوری که یک تصویر قابل انتقال باشد) به عقب منتقل شود. برای ایجاد یک تصویر واضح، شفت حاوی 10000 الیاف است!
لوله های آب
برای شستن لنز و شفاف نگه داشتن دید، آب همراه داشته باشید.
کانال عملیات
لوازم جانبی را برای جراحی به انتهای تقطیر حمل می کند.
کابل های کنترل
کنترل می کند که انتهای تقطیر به کدام سمت خم شود.
کانال اختیاری اضافی
هوا یا دی اکسید کربن را به انتهای تقطیر و از آن می برد
پایان تقطیر
انتهای تقطیر به بدن بیمار وارد می شود. کنترل هایی در انتهای دید وجود دارد تا آن را در جهت دلخواه خم کند. تصویر توسط یک لنز در انتهای آن فوکوس می شود.
کاربردهای پزشکی آندوسکوپ و لیزر
کاربردهای پزشکی آندوسکوپ و لیزر
عملکرد فیبرهای نوری
فیبرهای نوری لوله های باریکی از الیاف شیشه ای با پوشش پلاستیکی هستند که نور را از یک سر به سر دیگر منتقل می کنند. نور از دیواره های فیبر منعکس می شود و حتی می تواند به گوشه ها بتابد. خواص فیبرهای نوری آنها را برای طیف وسیعی از کاربردها مفید می کند، از جمله:
پزشکی - برای انتقال تصاویر اندام ها و شریان ها
صنعتی - برای انتقال تصاویر از داخل ماشین آلات پیچیده
ارتباطات - برای انتقال داده ها در فواصل طولانی بدون از دست دادن انتقال
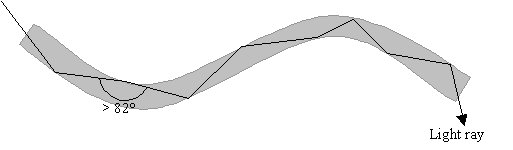
پرتوهای نور از بازتاب کلی درونی برای حرکت در طول الیاف استفاده می کنند. برای دستیابی به این امر، پرتو نور باید با حداقل زاویه 82 درجه به دیواره های فیبر برخورد کند، که زاویه بحرانی برای حرکت نور از شیشه به پلاستیک است. از آنجایی که الیاف بسیار باریک هستند، این معمولاً مشکلی ندارد.
درس فیزیک پزشکی
تولید اشعه ایکس
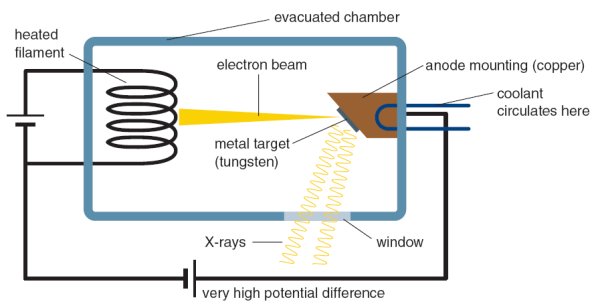
تصویربرداری اشعه ایکس و توموگرافی کامپیوتری
مقدمه ای بر تصویربرداری زیست پزشکی
شرح
بررسی جامع و یکپارچه از روش های تصویربرداری زیست پزشکی
یکی از اجزای مهم گسترش اخیر در مهندسی زیستی، حوزه تصویربرداری زیست پزشکی است. این کتاب پوشش عمیقی از زمینه تصویربرداری زیست پزشکی را با توجه ویژه به دیدگاه مهندسی ارائه می دهد.
مناسب به عنوان یک مرجع حرفه ای و به عنوان یک متن برای یک دوره یک ترم برای مهندسان پزشکی یا دانشجویان فناوری پزشکی، مقدمه ای بر تصویربرداری زیست پزشکی اصول و کاربردهای چهار تکنیک اولیه تصویربرداری پزشکی را پوشش می دهد: تصویربرداری تشدید مغناطیسی، اولتراسوند، پزشکی هسته ای و اشعه ایکس / توموگرافی کامپیوتری.
این کتاب با اتخاذ رویکردی در دسترس که شامل هر گونه ریاضیات و روشهای تبدیل ضروری است، بحثهای دقیقی را در مورد موارد زیر ارائه میکند:
اصول فیزیکی، طراحی ابزاری، استراتژی های اکتساب داده ها، تکنیک های بازسازی تصویر، و کاربردهای بالینی هر روش
پیشرفتهای اخیر مانند توموگرافی کامپیوتری مارپیچی چند تکه، تصویربرداری اولتراسونیک هارمونیک و ساب هارمونیک، اسکن PET چند برشی و تصویربرداری تشدید مغناطیسی عملکردی
ویژگی های کلی تصویر مانند وضوح فضایی و سیگنال به نویز، مشترک در همه روش های تصویربرداری
رشته های پزشکی که از فوتونیک و اپتیک سود می برند
رشتههای پزشکی تخصصی که از پیشرفتهای اپتیک و بیوفوتونیک بهره میبرند، شامل جراحی مغز و اعصاب، جراحی آندوسکوپی، تصویربرداری پزشکی، قلب و عروق و داروسازی میشود، اما محدود به آن نمیشود.
تشخیص غیر تهاجمی
تکنیک های تشخیصی غیر تهاجمی به روش های تشخیصی اطلاق می شود که متکی به شکستن پوست بیمار نیست. بسیاری از تکنیکهای اپتیک، مانند اشعه ایکس، میتوانند برای عبور از بافت یا قرار دادن دوربینها برای تشخیص از جمله آندوسکوپی و دوربینهای بلع استفاده شوند.
لیزرها
لیزرهای پزشکی در جراحی چشم، دندانپزشکی و رفع سرطان استفاده می شود. لیزر همچنین ابزار بسیار مهمی در درمان های پوست و زیبایی پوست است.
توالی یابی ژنومی
با استفاده از نشانگرهای فلورسنت که به پایگاه های DNA خاصی متصل می شوند، می توان از لیزر برای شناسایی نشانگرها و انجام توالی یابی ژنومی استفاده کرد. این دانش از ساختار ژنتیکی بدن ما به پیشرفت های دارویی جدید و درمان های بهتر بیماری کمک می کند.
تصویربرداری زیست پزشکی
تصویربرداری زیست پزشکی از اولین استفاده از تصاویر اشعه ایکس در اواخر قرن نوزدهم راه طولانی را پیموده است. تصویربرداری پزشکی مدرن هنوز به شدت به اشعه ایکس متکی است، اما پیشرفتهای دیگر شامل فلوروسکوپی، تصویربرداری تشدید مغناطیسی (MRI)، توموگرافی محوری کامپیوتری (CAT یا CT اسکن)، توموگرافی انتشار پوزیترون (PET) و رادیوگرافی پروجکشن، و همچنین استفاده از تکنیک ها و تجهیزات میکروسکوپی پیشرفته مانند میکروسکوپ های نیروی اتمی.
پیشرفته بیواپتیک و بیوفوتونیک
لبه برش های بیواپتیک و بیوفتونیک شامل استفاده از میکروسکوپ های نیروی اتمی برای دستکاری مستقیم غشای سلولی، دستکاری لیزری پروتئین ها و تکنیک های تصویربرداری پیشرفته مانند OCT (توموگرافی انسجام نوری) و CT (توموگرافی کامپیوتری) است.
درمان های فعال شده با نور
درمانهای فعالشده با نور از نور برای تشویق فرآیندهایی مانند بهبود زخم یا درمان سرطانها از طریق درمان فوتودینامیک استفاده میکنند.
ابزار تشخیصی جدید تصویربرداری تومورها را در طول جراحی سرطان مغز روشن می کند
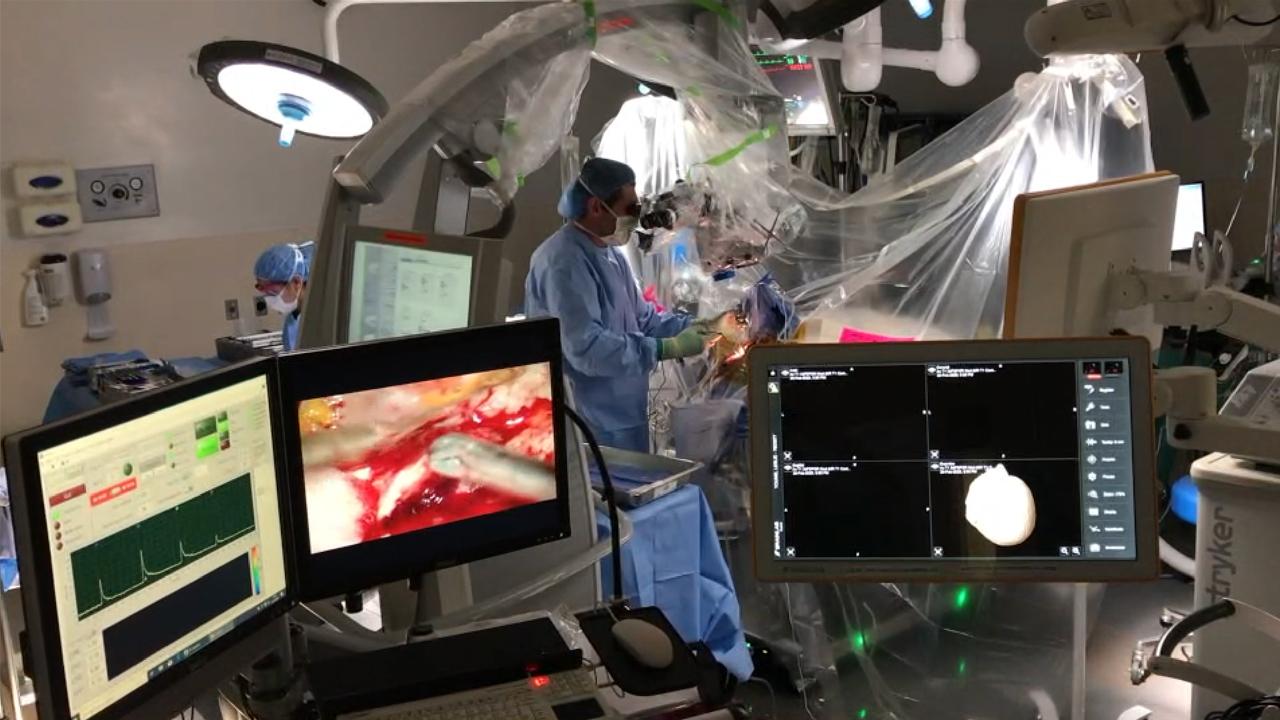
یک فناوری جدید تصویربرداری نوری که در دانشگاه کالیفرنیا، دیویس توسعه یافته است، می تواند به جراحان مغز و اعصاب کمک کند تا به صورت بصری و عینی بین بافت های سالم و سرطانی در طول جراحی های سرطان مغز تمایز قائل شوند. این فناوری که تصویربرداری مادام العمر فلورسانس (FLIm) نام دارد، می تواند به جراحان اجازه دهد تا تومورهای بدخیم را به طور دقیق تر و کامل تر حذف کنند.
فناوری های تصویربرداری در طی جراحی های سرطان مغز
در طول جراحی های سرطان مغز، جراحان مغز و اعصاب باید بافت های بدخیم در هم تنیده با مغز نرمال و عملکردی را شناسایی و حذف کنند. برای تشخیص خوب از بد، جراحان از فناوری های تصویربرداری کمکی از MRI های بزرگ و گران قیمت حین عمل گرفته تا ابزارهای تصویربرداری مبتنی بر رنگ میکروسکوپی استفاده می کنند.
این ابزارهای تصویربرداری تجاری موجود عموماً در تشخیص تومورهای کمتر تهاجمی کارایی پایینی دارند. آنها نیاز به برنامه ریزی قابل توجه قبل از جراحی، راه اندازی اتاق عمل ویژه و تجویز رنگ های بالقوه سمی به بیماران دارند.
FLIm چیست و چگونه کار می کند؟
جراح با یک کاوشگر تشخیصی قلم مانند دستی که با فناوری FLIm کار می کند، بافت ها را برای تغییرات فلورسنت مربوط به تغییرات در متابولیسم بافت اسکن می کند، عاملی که به شدت با تومورهای سرطانی مغز مرتبط است.
دستگاه FLIm نور ذاتی ساطع شده از بافت ها را گرفته و آنالیز می کند. این داده های بصری و کمی را با اندازه گیری های دقیق نور اتوفلورسانس ساطع شده از بافت ها فراهم می کند. این نور نشان دهنده وجود یا عدم وجود ناهنجاری های متابولیک و در نتیجه خطر سلول های سرطانی است.
بلوخ، جراح مغز و اعصاب و یک رهبر شناخته شده بین المللی در سرطان مغز، گفت: «اگر جراحان بتوانند تغییرات متابولیک در بافت را در طول عمل شناسایی و تجسم کنند، می توانند دقیقاً بافت های سرطانی را برداشته و بقای بیماران خود را بهبود بخشند.
FLIm استانداردهای مراقبت را برای جراحی های سرطان مغز تغییر می دهد؟
ویژگی دستگاه FLIm جمع آوری و نمایش داده ها ساده، سریع و انعطاف پذیر است. این امکان ادغام یکپارچه با تکنیک های تصویربرداری موجود در جراحی مغز و اعصاب را فراهم می کند. این یک جایگزین بسیار ارزان تر برای MRI و یک ابزار تشخیصی راحت تر و ایمن تر از تصویربرداری مبتنی بر رنگ است.
مارکو، پروفسور مهندسی بیوپزشکی، گفت: "مزیت کلیدی تکنیک FLIm ما این است که می تواند نفوذ تومور را در زمان واقعی در طول جراحی مغز و اعصاب بدون نیاز به مواد حاجب برجسته کند." ما از ویژگیهای فلورسانس ذاتی بافت مغز برای تشخیص مناطقی که تومور به مغز سالم نفوذ میکند، استفاده میکنیم.»
کاربرد FLIm در جراحی های سرطان مغز هنوز در مرحله نمونه اولیه است. در صورت تایید، انتظار می رود که جراحی های مغز و اعصاب را متحول کند.
تست و اعتبارسنجی FLIm
در مرحله اول مطالعه، محققان در حال جمعآوری دادههای ثبت FLIm در حین جراحی و مقایسه آنها با نتایج بیوپسی بافت هستند. این مرحله برای ایجاد دقت خواندن FLIM و ایجاد دستورالعمل هایی برای تفسیر داده ها ضروری است.
ما در حال ساخت مجموعه داده های آموزشی خود هستیم که بر اساس آن می توانیم معیارهای خاصی را ایجاد کنیم که می تواند بافت تومور را از بافت سالم متمایز کند. بلوخ گفت: ما قدرت پیشبینی این دستورالعملها را در مرحله دوم مطالعه تأیید خواهیم کرد.
در مرحله دوم، محققان از این فناوری برای هدایت حذف تومورهای مغزی استفاده خواهند کرد. آنها میزان بهبود حذف تومور و بقای بیمار را تعیین خواهند کرد.
بلوچ افزود: «ما معتقدیم که استفاده از FLIm در جراحیهای سرطان مغز باعث پیشرفت این زمینه و بهبود شانس بقا برای بیماران مبتلا به سرطان مغز میشود». این فناوری بومی دانشگاه کالیفرنیا دیویس ممکن است به استاندارد بعدی مراقبت تبدیل شود که به طور گسترده در جراحی های سرطان پذیرفته شده است.