Sepanta Laser Spadan
شرکت سپنتا لیزر اسپادان سهامی خاصSepanta Laser Spadan
شرکت سپنتا لیزر اسپادان سهامی خاصهدف گیری نوری سلول های سرطانی، بافت سالم را بدون آسیب می گذارد
یک گروه تحقیقاتی در دانشگاه اوکایاما در حال کار بر روی روشی برای جلوگیری از آسیب سلول های سالم در طول درمان سرطان هستند. این گروه در حال توسعه یک روش القای نور برای تحریک آپوپتوز سلولی تنها در سلولهای هدف هستند، با استفاده از پروتئین فعال شده با نور به جای مواد شیمیایی.
در حالی که دارو درمانی به عنوان ابزار اصلی درمان سرطان باقی می ماند، بسیاری از داروها یک مشکل مشترک دارند: آنها نه تنها بر روی سلول های سرطانی، بلکه روی سلول های سالم اطراف نیز اثر می گذارند و باعث واکنش های نامطلوب ناخواسته می شوند.
چندین روش درمانی وجود دارد که از نور برای از بین بردن سرطان استفاده می کنند. به عنوان مثال، فوتوایمونوتراپی یک فرم مولکولی هدفمند از فتوتراپی است که درمان فتودینامیک تومور را با ایمونوتراپی ترکیب می کند تا سلول های سرطانی را از بین ببرد.
پروفسور یوکی سودو گفت: "این روش ها از مواد شیمیایی استفاده می کنند و با تکیه بر آنزیم های فعال یا گرما باعث نکروز فیزیکی می شوند." بنابراین، ما نمیتوانیم واکنشهای نامطلوب را هر چقدر هم که آنها را بهبود بخشیم، حذف کنیم.»
سودو و تیمش به جای استفاده از نکروز برای از بین بردن سلولهای سرطانی، یک روش نوری برای تنظیم مرگ سلولی آپوپتوز ایجاد کردند - فرآیندی که طی آن سلولهای ناخواسته به طور فعال کشته میشوند تا ارگانیسم زنده بماند. محققان با کنترل pH درون سلولی با پروتئین های پمپ پروتون جاذب نور از خانواده رودوپسین به آپوپتوز رسیدند.
سودو گفت: «ما فکر میکردیم که اگر بتوانیم آپوپتوز را در سلولهای سرطانی هدف با استفاده از پروتئینها به جای مواد شیمیایی القا کنیم، میتوانیم به پیشرفتی در درمان سرطان بدون عوارض جانبی همراه کمک کنیم.»
به عنوان بخشی از یک رویکرد نوری برای درمان سرطان که توسط تیمی در دانشگاه اوکایاما توسعه یافته است، AR3، یک پروتئین فعال شده با نور از خانواده رودوپسین، در داخل سلول های سرطانی سنتز می شود و سپس نور اعمال می شود و آپوپتوز سلولی را القا می کند. با حسن نیت از دانشگاه اوکایاما و JST.
محققان بر روی آرکائرودوپسین-3 (AR3)، یک پروتئین جاذب نور از دسته رودوپسین تمرکز کردند که توانایی پمپ کردن یون های هیدروژن را به بیرون از سلول نشان داده است. با کاهش غلظت یون هیدروژن سلول، سلول قلیایی تر می شود. و قلیایی شدن سلول می تواند باعث آپوپتوز شود.
بر اساس این دانش، گروه تحقیقاتی شروع به آزمایش سلولها کردند تا ببینند آیا میتوان آنها را با استفاده از AR3 برای القای آپوپتوز به اندازه کافی قلیایی ساخت. محققان AR3 را در سلول های مشتق از سرطان انسان سنتز کردند و سپس سلول ها را در معرض نور سبز با طول موج تقریبی 550 نانومتر قرار دادند.
انقباض ناشی از قلیایی شدن سلول های HeLa انسانی که در pH 9.0 کشت شده بودند به طور قابل توجهی توسط AR3 فعال شده با نور تسریع شد. محققان مشاهده کردند که بیشتر سلول ها در عرض سه ساعت تحت آپوپتوز قرار گرفتند.
محقق Shin Nakao، یکی از دانشجویان سودو، آزمایشی موازی انجام داد که در آن شرایط pH اعمال شده روی سلول ها در pH فیزیولوژیکی خنثی 7.4 بود. یک تجزیه و تحلیل بیوشیمیایی نشان داد که قلیایی شدن داخل سلولی ناشی از AR3 مسیر سیگنالینگ آپوپتوز میتوکندری را تحریک می کند که منجر به مرگ سلولی همراه با تغییرات مورفولوژیکی می شود.
PH اندازه گیری غلظت یون هیدروژن در یک محیط است و به عنوان شاخص اسیدیته، خنثی بودن و قلیاییت استفاده می شود. سودو گفت: "من فکر می کردم که آزمایش رویکرد ما قطعا نمی تواند در شرایط خنثی انجام شود." سلولها وقتی در محلول قلیایی خیسانده میشوند میمیرند و من فکر کردم که آیا میتوان این فرآیند را با استفاده از AR3 تسریع کرد. بنابراین، من فقط در pH 9 (قلیایی) آزمایش کردم. با این حال، دانشآموز آزمایشی را با pH 7 (خنثی)، یعنی شرایطی که معمولاً در بدن انسان رخ میدهد، انجام داد.
در PH خنثی، مشاهده نتایج در مدت زمان طولانیتری ضروری بود، اما آزمایش در نهایت موفق شد. سودو گفت: "اگر استراتژی ما در pH خنثی عمل کند، می توان از آن برای توسعه درمان استفاده کرد."
ناکائو افزود: «من میخواستم شرایط را برای بیماران قابل اجرا کنم، کاری که در pH 9 قابل انجام نیست. "بنابراین، من رویکردمان را در pH 7 امتحان کردم. این اتفاق افتاد، بنابراین خوشحالم که آن را امتحان کردم."
سپس محققان رویکرد خود را در آزمایشهای in vivo آزمایش کردند. آنها AR3 را روی نورون های حسی C. elegans سنتز کردند و فقط سلول های عصبی را هدف قرار دادند. هنگامی که بدن C. elegans در معرض نور سبز قرار گرفت، تنها نورونهایی که AR3 را سنتز میکنند، واکنش حسی کاهشیافتهای به مواد شیمیایی نشان دادند. به نظر میرسد که یونهای هیدروژن توسط AR3 از این نورونها پمپ شده و باعث قلیایی شدن سلولها و مرگ آنها شده است.
بر اساس این نتایج، محققان به این نتیجه رسیدند که AR3 میتواند باعث آپوپتوز در سلولهای هدف در هنگام قرار گرفتن در معرض نور شود.
محققان رویکرد خود را در قلیاییسازی سلولها با روشی که واکسن پیامرسان RNA (mRNA) برای COVID-19 کار میکند، مقایسه میکنند. همانطور که mRNA برای سنتز پروتئین های لازم به سلول ها تزریق می شود، ژن های AR3 باید به سلول های سرطانی وارد شوند تا سلول ها بتوانند AR3 را سنتز کنند. نشانگرهای ژنتیکی را می توان تنها برای سنتز AR3 در سلول های هدف استفاده کرد.
سودو گفت: "با استفاده از روش آپوپتوز سلولی القا شده توسط نور، که در آن AR3 فقط در سلول های سرطانی انسان سنتز می شود، می توان سلول های بیمار را بدون ایجاد واکنش های نامطلوب در سلول های سالم اطراف از بین برد."
این گروه گفت که قصد دارد روی بافت پستانداران آزمایش کند. رویکرد محققین به آپوپتوز ناشی از عکس پتانسیل بهعنوان یک ابزار اپتوژنتیک برای از بین بردن انتخابی سلولهای هدف با وضوح فضایی و زمانی بالا دارد.
برخی از مردم ممکن است فکر کنند که چون رویکرد ما سرطان را با نور از بین میبرد، مانند روشهای قبلی است. با این حال، استراتژی ما حول آپوپتوز به جای نکروز متمرکز است و بنابراین اساساً متفاوت است. سودو گفت: رویکرد ما میتواند به روشهای درمانی کاملاً جدید منجر شود.
اپتوژنتیک
اپتوژنتیک استفاده از پروتئین های حساس به نور را با استراتژی های هدف گیری ژنتیکی ترکیب می کند. در سال های اخیر، جعبه ابزار اپتوژنتیک توسعه یافته، درک ارتباطات سلولی و سیگنال دهی را از واحدهای منفرد به کل شبکه ها گسترش داده است. این فصل مروری بر آخرین رویکردهای مولکولی و مهندسی برای ایجاد انواع ابزارهای اپتوژنتیکی ارائه می دهد که نورون ها را به نور پاسخ می دهند. این کار با معرفی انواع مختلف پروتئینهای فعال شده با نور میکروبی و مهرهداران، خواص عمومی و کاربردهای آنها آغاز میشود. سپس پروتئینهای جدید فعال شده با نور را برای تحریک سریع اپتوژنتیک و خاموش کردن نورونها با تمرکز اصلی بر تغییرات اخیر، جهشها و استراتژیهای هدفگیری در بخشهای سلولی خاص توصیف میکند. علاوه بر این، این فصل همچنین مزایای گیرندههای متصل به پروتئین G فعال شده با نور (GPCRs) و آنزیمها را برای کنترل آبشارهای سیگنالینگ عصبی/سلولی و برهمکنشهای پروتئین-پروتئین برای طیف وسیعی از کاربردها مورد بحث قرار خواهد داد.ابزار اپتوژنتیک دینامیک مکانیک سلولی و بافتی را به نور می آورد
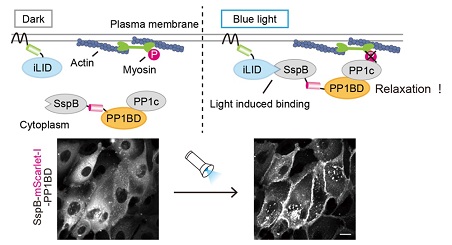
طراحی سیستم OptoMYPT (بالا). قرار گرفتن در معرض نور آبی باعث انتقال SspB-PP1BD و PP1c درون زا از سیتوپلاسم به غشاء می شود که منجر به غیرفعال شدن میوزین در نزدیکی غشاء می شود. تصاویر زیر جذب غشاء SspB-PP1BD در مواجهه با نور آبی را نشان می دهد.
ابزار اپتوژنتیک دینامیک مکانیک سلولی و بافتی را به نور می آورد
یک تیم تحقیقاتی در موسسه ملی بیولوژی پایه (NIBB) یک ابزار اپتوژنتیکی را توسعه دادند که میتواند نیروی انقباضی سلولی را کاهش دهد تا درک بهتری از چگونگی نیروهای انقباضی ایجاد شده توسط سلولها - نیروهایی که بر مجموعهای از فرآیندهای بیولوژیکی از جمله تحرک سلولی، سیتوکینز و بافت تأثیر میگذارند. مورفوژنز - بر پویایی سلول تأثیر می گذارد. این ابزار که OptoMYPT نام دارد از نور آبی برای ایجاد آرامش در انقباض اکتومیوزین در سطح درون سلولی استفاده می کند. میوزین II غیر عضلانی را غیرفعال می کند، پروتئینی که به اکتین متصل می شود و در هماهنگی با رشته های اکتین، انقباض سلولی ایجاد می کند.
محققان دریافتند که نور آبی از طریق OptoMYPT برای کاهش نیروی انقباضی اکتومیوزین در سلولهای پستانداران و جنین Xenopus کافی است.
به گفته کازوهیرو آئوکی، پروفسور NIBB، تیم بر این باور است که این ابزار برای درک پدیدههای مختلف جنینی و بیولوژیکی سلولی مربوط به اسکلت سلولی اکتومیوزین مفید خواهد بود.
آئوکی گفت: "ما در آینده انتظار داریم که بتوان از آن برای طراحی آزادانه شکل سلول ها و بافت ها و برای تشکیل اندام های مصنوعی استفاده کرد."
محققان بر روی زیرواحد هدف 1 میوزین فسفاتاز (MYPT1)، پروتئینی که برای غیرفعال کردن میوزین لازم است، برای توسعه OptoMYPT تمرکز کردند. MYPT1 پروتئین فسفاتاز 1c (PP1c) را در مجاورت میوزین فسفریله می آورد که منجر به دفسفوریلاسیون و غیرفعال شدن میوزین می شود.
OptoMYPT از دامنه اتصال PP1c MYPT1 برای دستکاری نوری محلی سازی PP1c که در ابتدا در سلول ها وجود داشت استفاده می کند.
محققان یک دامنه اتصال به PP1c از MYPT1 را با یک دایمرکننده اپتوژنتیک ترکیب کردند تا به جذب وابسته به نور PP1c درون زا به غشای پلاسمایی اجازه دهند. آنها از یک پروتئین فعال کننده نوری به نام iLID (Dimer بهبود یافته ناشی از نور) برای کنترل محلی سازی و فعالیت پروتئین ها با نور استفاده کردند. تابش نور آبی باعث می شود که پروتئین iLID به پروتئین های اتصال تک رشته ای (SspB) متصل شود.
محقق Kei Yamamoto گفت: "ابتدا، پروتئین iLID در غشای سلولی موضعی می شود، در حالی که SspB ترکیب شده با PP1BD MYPT1 در سیتوپلاسم بیان می شود." سپس قرار گرفتن در معرض نور آبی باعث انتقال SspB-PP1BD از سیتوپلاسم به غشاء از طریق اتصال به iLID می شود که منجر به جذب مشترک PP1c درون زا به غشاء می شود. در نهایت، PP1c جذب شده توسط غشاء، میوزین را در نزدیکی غشای سلولی دفسفریله و غیرفعال می کند.
هنگامی که سلول های بیان کننده OptoMYPT در معرض تابش نور آبی قرار گرفتند، PP1c به غشای سلولی منتقل شد و نیروی انقباضی با واسطه اکتین و میوزین کاهش یافت.
هنگامی که محققان برای تضعیف نیروی کششی ایجاد شده در قشر سلول، نور آبی را به هر دو قطب سلول تقسیم میتابانند، نتیجه شتاب در سرعت نفوذ شیار شکاف سلولی بود. هنگامی که کشش قشر سلولی تنها در یک طرف ضعیف شد، محققان همچنین دریافتند که یک جریان سیتوپلاسمی نوسانی بین دو سلول دختر رخ می دهد.
قدرت و تقارن نیروهای ایجاد شده در سطح سلول برای پیشرفت طبیعی تقسیم سلولی ضروری است.
سیستم OptoMYPT میتواند فرصتهایی برای درک بهتر مکانیک مورفوژنز و شکلدهی مورفولوژی سلولها و بافتها با دقت و انعطافپذیری فراهم کند. با ترکیب ابزارهای اپتوژنتیکی پاسخگو به نور قرمز با ابزارهای پاسخگو به نور آبی مانند OptoMYPT، دانشمندان می توانند مورفولوژی پیچیده تری را با افزایش یا کاهش نیروی انقباضی در همان سلول ها و بافت ها ایجاد کنند.
ترمیم بینایی جزئی از طریق اپتوژنتیک
اپتوژنتیک - که شامل استفاده از مهندسی ژنتیک و نور برای کنترل عملکرد سلول های عصبی است - ثابت کرده است که یک روش انقلابی در آزمایشگاه زیست شناسی ، امکان نقشه برداری از شبکه های عصبی جوندگان و حتی پستانداران را فراهم می کند. این روش همچنین محققان را به عنوان راهی بالقوه به سمت درمان برای معالجه برخی از بیماریهای مغز و اعصاب و فیزیولوژیک در انسان تحریک کرده است.
اپتوژنتیک
اپتوژنتیک فناوری جدیدی از رابط مغز که از دیدابی زیستی منشا می گیرد
Optogenetics یک تکنیک تحریک مغزی است که در آن فعالیت سلولهای تحریک پذیر ، مانند سلول های عصبی یا آستروسیت ، با قرار گرفتن سلول های هدف در معرض پالس های طول موج مناسب ، تعدیل می شود. قبل از آزمایش های اپتوژنتیک ، ما سازه های ژنتیکی خاصی را برای بیان سلول های یونی فعال شده با نور یا پمپ های یون و تولید حساسیت به نور ، به سلول های هدف می رسانیم. هنگامی که این پروتئین ها تولید می شوند ، ما می توانیم فعالیت سلول را دقیقاً با قرار دادن چنین سلول هایی در توالی پالس های نور تعدیل کنیم. ادامه مطلب ...اپتوژنتیک چیست؟
اپتوژنتیک چیست؟
اپتوژنتیک ترکیبی از دستکاری ژن ها و اپتیک در بافت های زنده است. در این روش از پروتئین های پاسخ دهنده نور به نام اوپسین استفاده می شود. این اجازه می دهد تا دانشمندان نورون های انتخابی را دقیقاً و انتخابی روشن یا خاموش کنند.
اپتوژنتیک
این جلسه موضوعی به طور خاص بر تحقیقات پیشرفته و ابزارها و تکنیک های نوآورانه جدید متمرکز است که به دنبال افزایش دانش بنیادی در مورد مغز و سیستم عصبی است.
اپتیک یک جعبه ابزار منحصر به فرد برای تصویربرداری چند مقیاس و دستکاری مغز زنده و سالم ارائه می دهد. استراتژی های جدید اقدامات نوری عملکرد عصبی را ارائه می دهند و ابزارهایی مانند اپتوژنتیک کنترل عملکرد سلول را با نور امکان پذیر می کند. روش های جدید همچنین امکان تجزیه خصوصیات مولکولی ، ژنتیکی ، ساختاری و پیوندی سیستم عصبی را از مقیاس فوق العاده به مقیاس های ارگانیسم فراهم می کند.
