
Sepanta Laser Spadan
شرکت سپنتا لیزر اسپادان سهامی خاص
Sepanta Laser Spadan
شرکت سپنتا لیزر اسپادان سهامی خاصپیشرفت تحقیقات پزشکی با دستگاه های اپتوژنتیک قابل کاشت
اپتوژنتیک یک رشته نوظهور است که از نور و مهندسی ژنتیک برای شناسایی و کنترل فعالیت پروتئین ها یا نورون های اصلاح شده ژنتیکی استفاده می کند.
کار در زمینه اپتوژنتیک چندین دهه پیش آغاز شد، با این حال، در سال 2002 زمانی که زملمن و همکارانش روشی را برای فعال کردن گروههایی از نورونهای حساس به رودوپسین از طریق تحریک نوری ایجاد کردند، اولین پیشرفت خود را در علوم اعصاب جریان اصلی ایجاد کرد. از آن زمان، دانشمندان به طور فزاینده ای به حوزه اپتوژنتیک علاقه مند شده اند و تحقیقات زیادی برای استفاده از آن در کاربردهای متعدد انجام شده است.
اپتوژنتیک کاربردهای متعددی را در بخشهای مختلف، از فناوری گرفته تا کشاورزی، توسعه داده است. در اینجا، ما بر چگونگی تحول در تحقیقات پزشکی برای تسهیل تشخیص سریع بیماری و ارائه نظارت و گزینه های درمانی جدید برای بیماری های مختلف تمرکز می کنیم.
رویکرد اپتوژنتیک نیازی به استفاده از عینک تشدید کننده ندارد. اعتبار: فناوری های نانوسکوپی
رویکرد اپتوژنتیک نیازی به استفاده از عینک تشدید کننده ندارد. اعتبار: فناوری های نانوسکوپی
بعلاوه، اگر از مواد فتوشیمیایی استفاده می شود، باید رهایش آهسته طولانی مدت را برای به حداقل رساندن فرکانس تزریق نشان دهند. سیستم کلی بازیابی بینایی در صورت اثبات اثر نامطلوب باید قابلیت خاموش شدن را داشته باشد و در حالت ایده آل باید قابل ارتقا باشد. ایساکف اظهار داشت: «فهرست چالش ها دلهره آور است. اما ما داریم به آنجا میرسیم. بسیاری از جعبهها قبلاً بررسی شدهاند و ما مسیری را برای بقیه باز کردهایم.»
بهبود بینایی معنی دار از نظر بالینی
به گفته سامارندرا موهانتی، مانع درمان ترکیبی با استفاده از دستگاههای نوری در کنار اپسین، این است که اطمینان حاصل شود که سمیت نوری در استفاده طولانی مدت محدود است. یک چالش دیگر تطبیق پرتو شبیهسازی پیشبینیشده با سلولهای انتقال یافته با اپسین در شبکیه است که میتوانند تکهای یا در قالب حلقه مرتب شوند. حتی ممکن است سیستم نیاز به ردیابی حرکت چشم داشته باشد و به طور همزمان پرتو اسکن را با توجه به نواحی ترانسدود شده شبکیه تغییر مکان دهد.
در سال 2021، نانوسکوپ نتایج یک کارآزمایی بالینی را منتشر کرد که در آن ژن درمانی اپتوژنتیک این شرکت بینایی معنادار بالینی را به 11 بیمار نابینا شده توسط رتینیت پیگمانتوزا بازگرداند. به گفته این شرکت، این نتایج نشان دهنده اولین بهبود عملکردی معنی دار بالینی است که با درمان اپتوژنتیک به دست آمده است، و انتظار می رود نتایج مثبت بیشتری در پی داشته باشد.
این شرکت در آن زمان خاطرنشان کرد: «ما در یک برنامه توسعه بالینی در مراحل پایانی هستیم، یک کارآزمایی تصادفی دو ماسک چند مرکزی در ایالات متحده، با دادههای بسیار هیجانانگیزی که باید درمان را برای بیماران تسریع کند». ما امیدواریم با Opsin چند مشخصه و پلتفرمهای تحویل ویروسی/غیر ویروسی خود، به جمعیت گستردهای از بیماران مبتلا به شبکیه به شدت تحلیل رفته یا نیمه تحلیل رفته رسیدگی کنیم.
در کنار این پیشرفت در بازگرداندن بینایی به افرادی که آن را از دست دادهاند، اپتوژنتیک همچنین میتواند به بیماران مبتلا به شبکیه نیمه تحلیلرفته نیز رسیدگی کند و با آتروفی جغرافیایی در AMD خشک مقابله کند و در نتیجه به یک بیماری رایج دیگر رسیدگی کند. این امر مستلزم محلی سازی تحویل اپسین به نواحی آتروفیک است.
Mohanty اظهار داشت: "ما یک رویکرد تحویل نوری غیر ویروسی با هدایت OCT ایجاد کردهایم تا ژنهای رمزگذاری کننده اپسین را به مناطق هدف شبکیه ارائه دهیم." این امر التهاب ناشی از استفاده از کپسیدهای ویروسی را از بین میبرد و همچنین به ما اجازه میدهد که سوژه را در همان نواحی آتروفیک تازه تکاملیافته در این بیماریهای پیشرونده دژنراتیو شبکیه دوز مجدد کنیم یا یک اپسین بهبودیافته را تحویل دهیم.»
تیم هیز یک نویسنده مستقل در بریتانیا است. او قبلاً سردبیر صنعت optics.org و مجله Optics & Laser Europe بود. این مقاله در اصل در 2022 SPIE Photonics West Show Daily ظاهر شد.
اپتوژنتیک مسیری امیدوارکننده برای بازیابی بینایی
اپتوژنتیک مسیری امیدوارکننده برای بازیابی بینایی
ترجمه با مهندس شکوفه ساتری
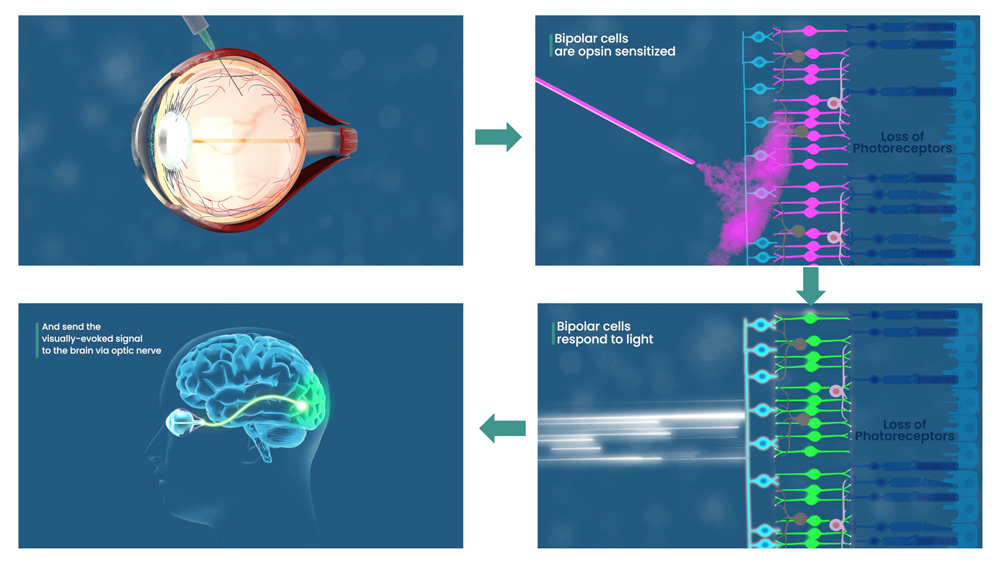
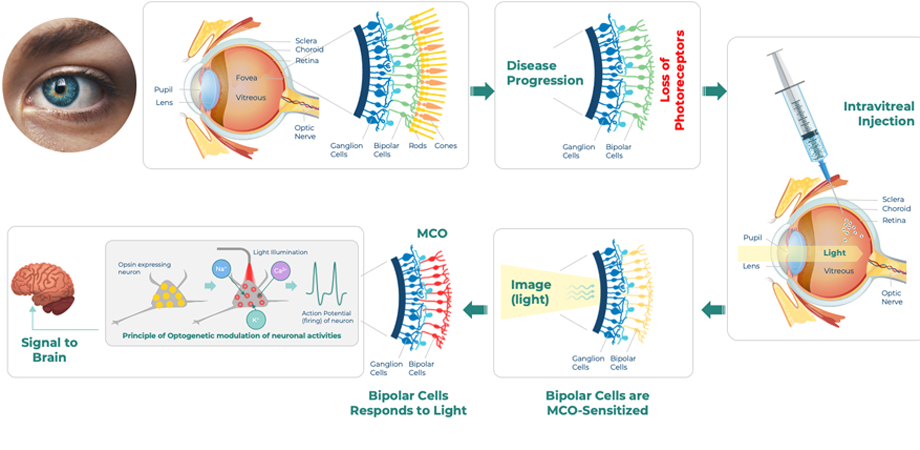
درمان اپتوژنتیک MCO نانوسکوپ برای ترمیم بینایی. اعتبار: فناوری های نانوسکوپی.
از دست دادن بینایی می تواند نتیجه بسیاری از شرایط مختلف باشد، به طوری که تصور می شود بیماری ارثی شبکیه شایع ترین علت نابینایی در کشورهای توسعه یافته است. مدیریت تمایل به اقدامات حمایتی به جای درمان دارد، اگرچه روشهای جراحی قابل توجهی با استفاده از انواع مختلف ایمپلنتهای شبکیه نیز توسعه یافتهاند.
اپتوژنتیک، که در آن فعالیت نورون ها یا سلول های دیگر تحت تأثیر نور فرودی قرار می گیرد، می تواند راه حل جذاب تری ارائه دهد. ممکن است بتوان از یک رویکرد اپتوژنتیک برای حساس کردن نورونهای ثانویه و سوم شبکیه چشم به نور استفاده کرد و به آنها اجازه داد بهطور مؤثری جای گیرندههای منحط یا ناکارآمد مسئول از دست دادن بینایی را بگیرند.
این موضوع موضوع جلسه ای در کنفرانس اپتوژنتیک و دستکاری نوری در SPIE Photonics West در ژانویه بود، جایی که سامارندرا موهانتی و تیمی از نانوسکوپ شرکت کنندگان را در مورد آخرین پیشرفت ها در زمینه درمان اختلالات مختلف شبکیه به روز کردند.
موهانتی اظهار داشت: «اپتوژنتیک میتواند نورونهای زندهمانده را حساس به نور کند، تا جایگزین عملکرد حسگر نور گیرندههای غیرفعال شود». "برای اینکه آنها به طور مناسب حساس به نور باشند، به عنوان مثال حساس به محیط باند پهن، به مهندسی مولکولی مناسب به علاوه حساسیت کاوشگر اپتوژنتیک بستگی دارد.
پروتئین opsin که ما استفاده می کنیم و با استفاده از یک ویروس مرتبط با آدنو (AAV) به عنوان ناقل تحویل می شود، باید به اندازه کافی حساس باشد که نورون ها در سطوح کم نور بدون ایجاد سمیت نوری فعال شوند. اپتوژنتیک شامل مولکول های طراحی شده از میکروب ها معمولاً به عنوان یک مهانتی افزود: سیستم تک جزیی، در حالی که انتقال دید طبیعی در انسان شامل تعامل چندین مولکول است، بنابراین سینتیک اپسین باید به اندازه کافی سریع باشد تا امکان پردازش بصری صحنه های متحرک را فراهم کند.
چالش با رویکرد opsin این است که همه ویژگیهای ایدهآل مانند حساسیت بالا، پاسخ طیفی وسیع و پاسخ سریع روشن و خاموش را داشته باشیم که در یک سیستم عملی قابل تشخیص باشند. Nanoscope Technologies اپسینی به نام Multi-Characteristic Opsin توسعه داده است که در آن ساختار منحصر به فرد - یک کانال یونی گذرنده که به یک لیگاند و تقویت کننده متصل شده است - منجر به مکانیسم خاصی از عمل می شود. هدف این است که اجازه دهیم محدوده دینامیکی بازسازی بینایی اپتوژنتیک به چندین مکانیسم مکمل مورد استفاده در چشم طبیعی نزدیک شود.
موهانتی گفت: «مسئله دیگر مربوط به تحویل اپسین به منظور دستیابی به انتقال بالا در سلول های هدف بدون ایجاد التهاب است. موهانتی گفت: "ناقل AAV با دوز بالا ما التهاب محدود و به خوبی کنترل شده را در یک دوره طولانی نشان داده است، در حالی که سایر ناقل های ویروسی در دوز بالا ممکن است منجر به عوارض جانبی طولانی مدت شوند. بنابراین باید به شدت مورد مطالعه و کنترل قرار گیرد."
چالش های در حال رفع شدن
روشهای دیگر برای بازیابی بینایی میتوانند ترکیبی از یک اپسین و یک دستگاه خارجی را به کار گیرند. در حالی که رویکرد اپتوژنتیکی که توسط فناوریهای نانوسکوپ اتخاذ میشود نیازی به استفاده از عینک تقویتکننده ندارد، در عوض از ویژگیهای سفارشی اپسین استفاده میکند، روشهای جایگزین میتوانند از عینک به عنوان بخشی از پلتفرمهای نوری ترکیبی استفاده کنند که برای ثبت یک صحنه خارجی با دوربین و رله در نظر گرفته شده است. آن را به عنوان یک پرتو نور روبشی به شبکیه چشم می رساند. در این رویکردهای درمان ترکیبی، کنترل پالس و شدت نور ارسالی ضروری است، که اغلب از فناوریهای فوتونیک فعلی مانند دستگاههای MEMS، حسگرها و الگوریتمهای پردازش تصویر برای افزایش عملکرد کلی استفاده میکنند.
ایهود ایساکوف از دانشگاه کالیفرنیا، برکلی، که در مورد آن بحث خواهد کرد، اظهار داشت: «برخی از نسخههای این درمانها از عینکهای تشدیدکننده نور استفاده میکنند، و برخی دیگر از عینکهای هوشمند استفاده میکنند که الگوی نور را تغییر میدهند و آن را همانطور که معمولاً در مدار بالادست شبکیه رخ میدهد، تهویه میکنند». استفاده از اپسین میله ای و مخروطی برای ترمیم بینایی اپتوژنتیک در طول کنفرانس.
ما به سیستمی نیاز داریم که به اندازه کافی حساس باشد تا در نور اتاق و روی نمایشگرهای استاندارد رایانه کار کند، سیستمی که دقت بالایی داشته باشد و به اندازه کافی سریع باشد که از تار شدن سوژه یا محیط در حال حرکت جلوگیری کند. و تحویل ژن باید به همان اندازه باشد. ایساکوف گفت: شبکیه تا حد ممکن، در حالی که برای نوع سلولی که به طور متراکم نمایش داده می شود، انتخابی است.
اپتوژنتیک
اپتوژنتیک استفاده از پروتئین های حساس به نور را با استراتژی های هدف گیری ژنتیکی ترکیب می کند. در سال های اخیر، جعبه ابزار اپتوژنتیک توسعه یافته، درک ارتباطات سلولی و سیگنال دهی را از واحدهای منفرد به کل شبکه ها گسترش داده است. این فصل مروری بر آخرین رویکردهای مولکولی و مهندسی برای ایجاد انواع ابزارهای اپتوژنتیکی ارائه می دهد که نورون ها را به نور پاسخ می دهند. این کار با معرفی انواع مختلف پروتئینهای فعال شده با نور میکروبی و مهرهداران، خواص عمومی و کاربردهای آنها آغاز میشود. سپس پروتئینهای جدید فعال شده با نور را برای تحریک سریع اپتوژنتیک و خاموش کردن نورونها با تمرکز اصلی بر تغییرات اخیر، جهشها و استراتژیهای هدفگیری در بخشهای سلولی خاص توصیف میکند. علاوه بر این، این فصل همچنین مزایای گیرندههای متصل به پروتئین G فعال شده با نور (GPCRs) و آنزیمها را برای کنترل آبشارهای سیگنالینگ عصبی/سلولی و برهمکنشهای پروتئین-پروتئین برای طیف وسیعی از کاربردها مورد بحث قرار خواهد داد.ابزار اپتوژنتیک دینامیک مکانیک سلولی و بافتی را به نور می آورد
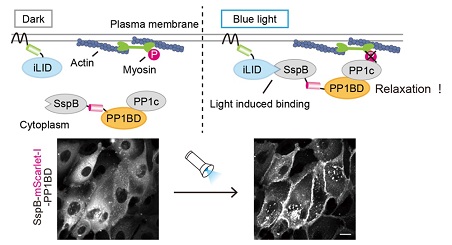
طراحی سیستم OptoMYPT (بالا). قرار گرفتن در معرض نور آبی باعث انتقال SspB-PP1BD و PP1c درون زا از سیتوپلاسم به غشاء می شود که منجر به غیرفعال شدن میوزین در نزدیکی غشاء می شود. تصاویر زیر جذب غشاء SspB-PP1BD در مواجهه با نور آبی را نشان می دهد.
ابزار اپتوژنتیک دینامیک مکانیک سلولی و بافتی را به نور می آورد
یک تیم تحقیقاتی در موسسه ملی بیولوژی پایه (NIBB) یک ابزار اپتوژنتیکی را توسعه دادند که میتواند نیروی انقباضی سلولی را کاهش دهد تا درک بهتری از چگونگی نیروهای انقباضی ایجاد شده توسط سلولها - نیروهایی که بر مجموعهای از فرآیندهای بیولوژیکی از جمله تحرک سلولی، سیتوکینز و بافت تأثیر میگذارند. مورفوژنز - بر پویایی سلول تأثیر می گذارد. این ابزار که OptoMYPT نام دارد از نور آبی برای ایجاد آرامش در انقباض اکتومیوزین در سطح درون سلولی استفاده می کند. میوزین II غیر عضلانی را غیرفعال می کند، پروتئینی که به اکتین متصل می شود و در هماهنگی با رشته های اکتین، انقباض سلولی ایجاد می کند.
محققان دریافتند که نور آبی از طریق OptoMYPT برای کاهش نیروی انقباضی اکتومیوزین در سلولهای پستانداران و جنین Xenopus کافی است.
به گفته کازوهیرو آئوکی، پروفسور NIBB، تیم بر این باور است که این ابزار برای درک پدیدههای مختلف جنینی و بیولوژیکی سلولی مربوط به اسکلت سلولی اکتومیوزین مفید خواهد بود.
آئوکی گفت: "ما در آینده انتظار داریم که بتوان از آن برای طراحی آزادانه شکل سلول ها و بافت ها و برای تشکیل اندام های مصنوعی استفاده کرد."
محققان بر روی زیرواحد هدف 1 میوزین فسفاتاز (MYPT1)، پروتئینی که برای غیرفعال کردن میوزین لازم است، برای توسعه OptoMYPT تمرکز کردند. MYPT1 پروتئین فسفاتاز 1c (PP1c) را در مجاورت میوزین فسفریله می آورد که منجر به دفسفوریلاسیون و غیرفعال شدن میوزین می شود.
OptoMYPT از دامنه اتصال PP1c MYPT1 برای دستکاری نوری محلی سازی PP1c که در ابتدا در سلول ها وجود داشت استفاده می کند.
محققان یک دامنه اتصال به PP1c از MYPT1 را با یک دایمرکننده اپتوژنتیک ترکیب کردند تا به جذب وابسته به نور PP1c درون زا به غشای پلاسمایی اجازه دهند. آنها از یک پروتئین فعال کننده نوری به نام iLID (Dimer بهبود یافته ناشی از نور) برای کنترل محلی سازی و فعالیت پروتئین ها با نور استفاده کردند. تابش نور آبی باعث می شود که پروتئین iLID به پروتئین های اتصال تک رشته ای (SspB) متصل شود.
محقق Kei Yamamoto گفت: "ابتدا، پروتئین iLID در غشای سلولی موضعی می شود، در حالی که SspB ترکیب شده با PP1BD MYPT1 در سیتوپلاسم بیان می شود." سپس قرار گرفتن در معرض نور آبی باعث انتقال SspB-PP1BD از سیتوپلاسم به غشاء از طریق اتصال به iLID می شود که منجر به جذب مشترک PP1c درون زا به غشاء می شود. در نهایت، PP1c جذب شده توسط غشاء، میوزین را در نزدیکی غشای سلولی دفسفریله و غیرفعال می کند.
هنگامی که سلول های بیان کننده OptoMYPT در معرض تابش نور آبی قرار گرفتند، PP1c به غشای سلولی منتقل شد و نیروی انقباضی با واسطه اکتین و میوزین کاهش یافت.
هنگامی که محققان برای تضعیف نیروی کششی ایجاد شده در قشر سلول، نور آبی را به هر دو قطب سلول تقسیم میتابانند، نتیجه شتاب در سرعت نفوذ شیار شکاف سلولی بود. هنگامی که کشش قشر سلولی تنها در یک طرف ضعیف شد، محققان همچنین دریافتند که یک جریان سیتوپلاسمی نوسانی بین دو سلول دختر رخ می دهد.
قدرت و تقارن نیروهای ایجاد شده در سطح سلول برای پیشرفت طبیعی تقسیم سلولی ضروری است.
سیستم OptoMYPT میتواند فرصتهایی برای درک بهتر مکانیک مورفوژنز و شکلدهی مورفولوژی سلولها و بافتها با دقت و انعطافپذیری فراهم کند. با ترکیب ابزارهای اپتوژنتیکی پاسخگو به نور قرمز با ابزارهای پاسخگو به نور آبی مانند OptoMYPT، دانشمندان می توانند مورفولوژی پیچیده تری را با افزایش یا کاهش نیروی انقباضی در همان سلول ها و بافت ها ایجاد کنند.
بیوفوتونیک با شکوفه ساتری
چالش ها و فرصت های بزرگ در بیوفوتونیک
شفاف سازی بافت با استفاده از هیدروژل های مبتنی بر آکریل آمید
روشنی [1] روشی برای شفاف سازی بافت با استفاده از هیدروژل های مبتنی بر آکریل آمید است که از داخل ساخته شده و به بافت متصل شده است و همانطور که در مقاله اولیه تعریف شده است ، نشان دهنده "تبدیل بافت بیولوژیکی دست نخورده به شکل ترکیبی است که در آن اجزای خاصی با عناصر برون زایی جایگزین می شوند که دسترسی یا عملکرد جدیدی را ارائه می دهند ". [1] هنگامی که با برچسب گذاری بر اساس آنتی بادی یا ژن همراه است ، CLARITY تصاویری بسیار دقیق از ساختار پروتئین و اسید نوکلئیک اندام ها ، به ویژه مغز را قادر می سازد. این توسط Kwanghun Chung و Karl Deisseroth در دانشکده پزشکی دانشگاه استنفورد توسعه داده شد. [2]
چندین مقاله منتشر شده روش CLARITY را برای طیف وسیعی از بافتها و بیماریها مانند ایمونوآنکولوژی سرطان سینه انسان ، [3] مغز انسان در بیماری آلزایمر ، [4] نخاع موش ، [5] مدل حیوانی مولتیپل اسکلروزیس ، اعمال کرده اند. [6] و گیاهان. [7] CLARITY همچنین با فن آوری های دیگر ترکیب شده است تا روش های جدید میکروسکوپی از جمله میکروسکوپ انبساط کانونی ، میکروسکوپ ورق نور SPIM و میکروسکوپ ورق نور بهینه سازی شده با وضوح (COLM) ترکیب شود.
ابزار اپتوژنتیک ارگانیک ارتباطات مغز را روشن می کند

تیم تحقیقاتی ، که توسط پروفسور اوفر ییشار رهبری می شود ، از روش های اپتوژنتیک برای مطالعه سیگنال هایی که بین نورون ها از طریق سیناپس مغز موش های زنده عبور می کند ، استفاده می کند. یژار گفت: "ما می توانیم وجود انتقال دهنده های عصبی مختلف را تشخیص دهیم ، اما نورون های مختلف این انتقال دهنده های عصبی را" متفاوت "می خوانند. "Optogenetics ما را قادر می سازد نه تنها" جوهر "را ببینیم ، بلکه واقعاً" پیام "را رمزگشایی کنیم."
Yizhar دریافت که رودوپسین های موجود به اندازه کافی دقیق و پایدار نیستند تا تیمش بتواند بررسی کند چه سیگنالی از طریق سیناپس های مختلف عبور می کند. برای درک بهتر نقش های مسیرهای مختلف ، دانشمندان باید رودوپسینی را پیدا کنند که کنترل بیشتری به آنها بدهد. یژار گفت: "ما تصمیم گرفتیم به اطراف نگاه کنیم و ببینیم چه راه حل های طبیعی وجود دارد."
پس از بررسی تعدادی از پروتئین های رودوپسین آلی ، دانشمندان انتخاب خود را به یک رودوپسین از یک پشه محدود کردند. آنها برای ارزیابی اثربخشی انتخاب خود ، پروتئین پشه را در برابر دارویی آزمایش کردند که قدرت فعالیت سیناپسی را کاهش می دهد. آنها دریافتند که رودوپسین مشتق شده از پشه انتقال عصبی را در سلول های عصبی به همان اندازه موثر می کند و رودوپسین پایدارتر است.
برخلاف دارویی که قسمت های متعددی از مغز را تحت تأثیر قرار می دهد و کنترل آن دشوار است ، رودوپسین پشه فقط بر نورون هایی که سنسور پشه ها را هنگام تابش نور به آنها تولید می کند ، تأثیر می گذارد. با استفاده از رودوپسین مشتق شده از پشه ، دانشمندان قادرند فعالیت سیناپسی مغز را در فضا و زمان تعدیل کنند.
برای آزمایش اثربخشی ابزار اپتوژنتیک جدید ، دانشمندان از آن برای جلوگیری از انتشار انتقال دهنده عصبی دوپامین در یک طرف مغز موش ها استفاده کردند. هنگامی که آنها نور سبز به نیمکره مغز نشان دادند و رودوپسین پشه را بیان کردند ، یک سوگیری یک طرفه متمایز در رفتار موش ها مشاهده کردند.
یژار می گوید: "یکی از مزایای اصلی رودوپسین پشه این است که قابل دوقطبی است - یعنی نیازی به طراوت ندارد - و به طور بالقوه بسیار خاص است ، به طوری که ما می توانیم سیناپسهای دقیق مورد علاقه خود را کنترل کنیم." "این یک فناوری بسیار هیجان انگیز است ، زیرا به ما امکان می دهد نقش مسیرهای خاص در مغز را به روشی که قبلاً امکان پذیر نبود کشف کنیم. ما فکر می کنیم این پروتئین پشه می تواند راه را برای ایجاد یک خانواده کامل از ابزارهای جدید اپتوژنتیک برای استفاده در تحقیقات علوم عصبی باز کند. "
توانایی رودوپسین پشه در سرکوب انتقال عصبی بین نورون ها می تواند روش های اپتوژنتیک را برای مطالعه انتقال عصبی در مغز بهبود بخشد و در نهایت منجر به درمان های جدید و بهتری برای بیماری های عصبی و روانی شود.