
Sepanta Laser Spadan
شرکت سپنتا لیزر اسپادان سهامی خاص
Sepanta Laser Spadan
شرکت سپنتا لیزر اسپادان سهامی خاصپارچه های ساطع کننده نور برای درمان فوتودینامیک: فناوری، کاربردهای تجربی و بالینی

با ادغام فیبرهای نوری پلاستیکی در ساختار بافتنی یا بافته شده، می توان انتشار نور را روی پارچه های نساجی بزرگ و انعطاف پذیر به دست آورد. همگنی توزیع نور فضایی با کنترل چگالی الیاف و زوایا و شعاع انحنا به دست می آید. این پارچه های ساطع کننده نور (LEF) را می توان به هر منبع نوری از 400 تا 1200 نانومتر متصل کرد. LEF در حال حاضر برای کاربردهای پیش بالینی و بالینی درمان فتودینامیک استفاده می شود. چندین مثال در این مقاله آورده شده است.
هدف گیری نوری سلول های سرطانی، بافت سالم را بدون آسیب می گذارد
یک گروه تحقیقاتی در دانشگاه اوکایاما در حال کار بر روی روشی برای جلوگیری از آسیب سلول های سالم در طول درمان سرطان هستند. این گروه در حال توسعه یک روش القای نور برای تحریک آپوپتوز سلولی تنها در سلولهای هدف هستند، با استفاده از پروتئین فعال شده با نور به جای مواد شیمیایی.
در حالی که دارو درمانی به عنوان ابزار اصلی درمان سرطان باقی می ماند، بسیاری از داروها یک مشکل مشترک دارند: آنها نه تنها بر روی سلول های سرطانی، بلکه روی سلول های سالم اطراف نیز اثر می گذارند و باعث واکنش های نامطلوب ناخواسته می شوند.
چندین روش درمانی وجود دارد که از نور برای از بین بردن سرطان استفاده می کنند. به عنوان مثال، فوتوایمونوتراپی یک فرم مولکولی هدفمند از فتوتراپی است که درمان فتودینامیک تومور را با ایمونوتراپی ترکیب می کند تا سلول های سرطانی را از بین ببرد.
پروفسور یوکی سودو گفت: "این روش ها از مواد شیمیایی استفاده می کنند و با تکیه بر آنزیم های فعال یا گرما باعث نکروز فیزیکی می شوند." بنابراین، ما نمیتوانیم واکنشهای نامطلوب را هر چقدر هم که آنها را بهبود بخشیم، حذف کنیم.»
سودو و تیمش به جای استفاده از نکروز برای از بین بردن سلولهای سرطانی، یک روش نوری برای تنظیم مرگ سلولی آپوپتوز ایجاد کردند - فرآیندی که طی آن سلولهای ناخواسته به طور فعال کشته میشوند تا ارگانیسم زنده بماند. محققان با کنترل pH درون سلولی با پروتئین های پمپ پروتون جاذب نور از خانواده رودوپسین به آپوپتوز رسیدند.
سودو گفت: «ما فکر میکردیم که اگر بتوانیم آپوپتوز را در سلولهای سرطانی هدف با استفاده از پروتئینها به جای مواد شیمیایی القا کنیم، میتوانیم به پیشرفتی در درمان سرطان بدون عوارض جانبی همراه کمک کنیم.»
به عنوان بخشی از یک رویکرد نوری برای درمان سرطان که توسط تیمی در دانشگاه اوکایاما توسعه یافته است، AR3، یک پروتئین فعال شده با نور از خانواده رودوپسین، در داخل سلول های سرطانی سنتز می شود و سپس نور اعمال می شود و آپوپتوز سلولی را القا می کند. با حسن نیت از دانشگاه اوکایاما و JST.
محققان بر روی آرکائرودوپسین-3 (AR3)، یک پروتئین جاذب نور از دسته رودوپسین تمرکز کردند که توانایی پمپ کردن یون های هیدروژن را به بیرون از سلول نشان داده است. با کاهش غلظت یون هیدروژن سلول، سلول قلیایی تر می شود. و قلیایی شدن سلول می تواند باعث آپوپتوز شود.
بر اساس این دانش، گروه تحقیقاتی شروع به آزمایش سلولها کردند تا ببینند آیا میتوان آنها را با استفاده از AR3 برای القای آپوپتوز به اندازه کافی قلیایی ساخت. محققان AR3 را در سلول های مشتق از سرطان انسان سنتز کردند و سپس سلول ها را در معرض نور سبز با طول موج تقریبی 550 نانومتر قرار دادند.
انقباض ناشی از قلیایی شدن سلول های HeLa انسانی که در pH 9.0 کشت شده بودند به طور قابل توجهی توسط AR3 فعال شده با نور تسریع شد. محققان مشاهده کردند که بیشتر سلول ها در عرض سه ساعت تحت آپوپتوز قرار گرفتند.
محقق Shin Nakao، یکی از دانشجویان سودو، آزمایشی موازی انجام داد که در آن شرایط pH اعمال شده روی سلول ها در pH فیزیولوژیکی خنثی 7.4 بود. یک تجزیه و تحلیل بیوشیمیایی نشان داد که قلیایی شدن داخل سلولی ناشی از AR3 مسیر سیگنالینگ آپوپتوز میتوکندری را تحریک می کند که منجر به مرگ سلولی همراه با تغییرات مورفولوژیکی می شود.
PH اندازه گیری غلظت یون هیدروژن در یک محیط است و به عنوان شاخص اسیدیته، خنثی بودن و قلیاییت استفاده می شود. سودو گفت: "من فکر می کردم که آزمایش رویکرد ما قطعا نمی تواند در شرایط خنثی انجام شود." سلولها وقتی در محلول قلیایی خیسانده میشوند میمیرند و من فکر کردم که آیا میتوان این فرآیند را با استفاده از AR3 تسریع کرد. بنابراین، من فقط در pH 9 (قلیایی) آزمایش کردم. با این حال، دانشآموز آزمایشی را با pH 7 (خنثی)، یعنی شرایطی که معمولاً در بدن انسان رخ میدهد، انجام داد.
در PH خنثی، مشاهده نتایج در مدت زمان طولانیتری ضروری بود، اما آزمایش در نهایت موفق شد. سودو گفت: "اگر استراتژی ما در pH خنثی عمل کند، می توان از آن برای توسعه درمان استفاده کرد."
ناکائو افزود: «من میخواستم شرایط را برای بیماران قابل اجرا کنم، کاری که در pH 9 قابل انجام نیست. "بنابراین، من رویکردمان را در pH 7 امتحان کردم. این اتفاق افتاد، بنابراین خوشحالم که آن را امتحان کردم."
سپس محققان رویکرد خود را در آزمایشهای in vivo آزمایش کردند. آنها AR3 را روی نورون های حسی C. elegans سنتز کردند و فقط سلول های عصبی را هدف قرار دادند. هنگامی که بدن C. elegans در معرض نور سبز قرار گرفت، تنها نورونهایی که AR3 را سنتز میکنند، واکنش حسی کاهشیافتهای به مواد شیمیایی نشان دادند. به نظر میرسد که یونهای هیدروژن توسط AR3 از این نورونها پمپ شده و باعث قلیایی شدن سلولها و مرگ آنها شده است.
بر اساس این نتایج، محققان به این نتیجه رسیدند که AR3 میتواند باعث آپوپتوز در سلولهای هدف در هنگام قرار گرفتن در معرض نور شود.
محققان رویکرد خود را در قلیاییسازی سلولها با روشی که واکسن پیامرسان RNA (mRNA) برای COVID-19 کار میکند، مقایسه میکنند. همانطور که mRNA برای سنتز پروتئین های لازم به سلول ها تزریق می شود، ژن های AR3 باید به سلول های سرطانی وارد شوند تا سلول ها بتوانند AR3 را سنتز کنند. نشانگرهای ژنتیکی را می توان تنها برای سنتز AR3 در سلول های هدف استفاده کرد.
سودو گفت: "با استفاده از روش آپوپتوز سلولی القا شده توسط نور، که در آن AR3 فقط در سلول های سرطانی انسان سنتز می شود، می توان سلول های بیمار را بدون ایجاد واکنش های نامطلوب در سلول های سالم اطراف از بین برد."
این گروه گفت که قصد دارد روی بافت پستانداران آزمایش کند. رویکرد محققین به آپوپتوز ناشی از عکس پتانسیل بهعنوان یک ابزار اپتوژنتیک برای از بین بردن انتخابی سلولهای هدف با وضوح فضایی و زمانی بالا دارد.
برخی از مردم ممکن است فکر کنند که چون رویکرد ما سرطان را با نور از بین میبرد، مانند روشهای قبلی است. با این حال، استراتژی ما حول آپوپتوز به جای نکروز متمرکز است و بنابراین اساساً متفاوت است. سودو گفت: رویکرد ما میتواند به روشهای درمانی کاملاً جدید منجر شود.
پوشش تحت تابش نور، درمان چاقی غیر جراحی را افزایش می دهد
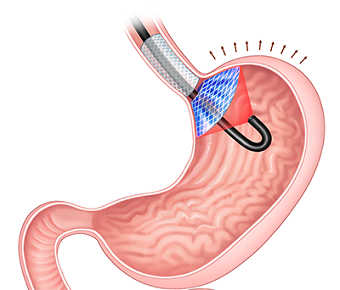
یک تیم تحقیقاتی چند مؤسسه ای در کره جنوبی عملکرد موجود ایمپلنت های سرکوب کننده اشتها در معده را با درمان فتودینامیک تقویت کرده اند و روی چنین ایمپلنتی را با رنگ فعال شده با نور می پوشانند که سلول های تولید کننده گرلین را که به عنوان "هورمون گرسنگی" شناخته می شود، می کشد. محققان در این کار از دستگاه های القا کننده سیری داخل معده یا ISD استفاده کردند و پوشش دادند. محققان در کار فعلی این ایمپلنت ها را در سال 2019 طراحی و معرفی کردند.
ایمپلنت های سرکوب کننده اشتها که می توانند مانند بادکنک های مینیاتوری در معده عمل کنند، جایگزین های غیرجراحی برای درمان چاقی هستند. این ایمپلنت ها را می توان از طریق دهان وارد معده کرد. ISDها شامل یک استنت است که در قسمت تحتانی مری قرار می گیرد و به دیسکی متصل می شود که در دهانه معده قرار دارد. دیسک دارای سوراخی در مرکز خود است که به غذا اجازه عبور می دهد.
اگرچه آزمایشات روی خوک ها نشان داد که ISD ها با افزایش احساس سیری و کاهش سطوح گرلین، که توسط سلول های نزدیک بالای معده تولید می شود، مصرف غذا و افزایش وزن را کاهش می دهند، این دستگاه عوارضی از جمله رفلاکس اسید ایجاد کرد.
هدف کار فعلی سرکوب بیشتر گرلین با پوشش دادن یک ISD با ترکیبی بود که میتواند برخی از سلولهای تولیدکننده گرلین را در اثر برهمکنش نور از بین ببرد. طراحی محققان در این کار، حذف ایمپلنت برای جلوگیری از عوارض جانبی مرتبط با طراحی اولیه دستگاه بود.
ایمپلنت (آبی و خاکستری) با فشار دادن روی معده احساس سیری ایجاد میکند و هنگامی که توسط لیزر (سیاه) فعال میشود، سلولهایی را که گرلین تولید میکنند، به نام «هورمون گرسنگی» میکشد. تحقیقات در سال 2019 منجر به توسعه دستگاهی برای درمان چاقی به روش غیرجراحی شد، اما عوارض جانبی از جمله رفلاکس اسید به همراه داشت. با حسن نیت از ACS Applied Materials & Interfaces.
محققان ISD ها را با متیلن بلو پوشاندند که یک داروی حساس کننده نور و تایید شده توسط FDA است. سپس آنها را در شکم خوک های جوان قرار دادند. هنگامی که آنها ISD های پوشش داده شده را در معرض نور لیزر قرار دادند، این پوشش اکسیژن منفرد را آزاد کرد که سلول های تولید کننده گرلین را که در نزدیکی آن قرار داشتند از بین برد و سپس به سرعت ناپدید شد.
پس از یک هفته، این درمان سلولهای گرلین و افزایش وزن بدن را در مقایسه با خوکهای درماننشده به نصف کاهش داد، اگرچه محققان گفتند که این تفاوتها در هفتههای بعد کاهش مییابد مگر اینکه درمان با نور تکرار شود. با این حال، با توسعه بیشتر، آنها بر این باورند که این روش می تواند به یک درمان کم تهاجمی برای کمک به کاهش وزن بیماران چاق تبدیل شود.
نویسندگان مقاله توسط کمک هزینه توسعه تجهیزات پزشکی کره که توسط دولت کره تامین می شود، حمایت شدند.
شکوفه ساتری
کاربرد لیزر در پزشکی
معرفی لیزرهای توان پاییناثرات لیزرهای کم قدرت
مکانیسم برهمکنش بافت
لیزر
درمان فتودینامیک
مقایسه لیزرهای توان بالا با لیزرهای توان پایین
روش های کاربرد لیزر توان پایین
رویکرد بالینی
