Sepanta Laser Spadan
شرکت سپنتا لیزر اسپادان سهامی خاصSepanta Laser Spadan
شرکت سپنتا لیزر اسپادان سهامی خاصهدف گیری نوری سلول های سرطانی، بافت سالم را بدون آسیب می گذارد
یک گروه تحقیقاتی در دانشگاه اوکایاما در حال کار بر روی روشی برای جلوگیری از آسیب سلول های سالم در طول درمان سرطان هستند. این گروه در حال توسعه یک روش القای نور برای تحریک آپوپتوز سلولی تنها در سلولهای هدف هستند، با استفاده از پروتئین فعال شده با نور به جای مواد شیمیایی.
در حالی که دارو درمانی به عنوان ابزار اصلی درمان سرطان باقی می ماند، بسیاری از داروها یک مشکل مشترک دارند: آنها نه تنها بر روی سلول های سرطانی، بلکه روی سلول های سالم اطراف نیز اثر می گذارند و باعث واکنش های نامطلوب ناخواسته می شوند.
چندین روش درمانی وجود دارد که از نور برای از بین بردن سرطان استفاده می کنند. به عنوان مثال، فوتوایمونوتراپی یک فرم مولکولی هدفمند از فتوتراپی است که درمان فتودینامیک تومور را با ایمونوتراپی ترکیب می کند تا سلول های سرطانی را از بین ببرد.
پروفسور یوکی سودو گفت: "این روش ها از مواد شیمیایی استفاده می کنند و با تکیه بر آنزیم های فعال یا گرما باعث نکروز فیزیکی می شوند." بنابراین، ما نمیتوانیم واکنشهای نامطلوب را هر چقدر هم که آنها را بهبود بخشیم، حذف کنیم.»
سودو و تیمش به جای استفاده از نکروز برای از بین بردن سلولهای سرطانی، یک روش نوری برای تنظیم مرگ سلولی آپوپتوز ایجاد کردند - فرآیندی که طی آن سلولهای ناخواسته به طور فعال کشته میشوند تا ارگانیسم زنده بماند. محققان با کنترل pH درون سلولی با پروتئین های پمپ پروتون جاذب نور از خانواده رودوپسین به آپوپتوز رسیدند.
سودو گفت: «ما فکر میکردیم که اگر بتوانیم آپوپتوز را در سلولهای سرطانی هدف با استفاده از پروتئینها به جای مواد شیمیایی القا کنیم، میتوانیم به پیشرفتی در درمان سرطان بدون عوارض جانبی همراه کمک کنیم.»
به عنوان بخشی از یک رویکرد نوری برای درمان سرطان که توسط تیمی در دانشگاه اوکایاما توسعه یافته است، AR3، یک پروتئین فعال شده با نور از خانواده رودوپسین، در داخل سلول های سرطانی سنتز می شود و سپس نور اعمال می شود و آپوپتوز سلولی را القا می کند. با حسن نیت از دانشگاه اوکایاما و JST.
محققان بر روی آرکائرودوپسین-3 (AR3)، یک پروتئین جاذب نور از دسته رودوپسین تمرکز کردند که توانایی پمپ کردن یون های هیدروژن را به بیرون از سلول نشان داده است. با کاهش غلظت یون هیدروژن سلول، سلول قلیایی تر می شود. و قلیایی شدن سلول می تواند باعث آپوپتوز شود.
بر اساس این دانش، گروه تحقیقاتی شروع به آزمایش سلولها کردند تا ببینند آیا میتوان آنها را با استفاده از AR3 برای القای آپوپتوز به اندازه کافی قلیایی ساخت. محققان AR3 را در سلول های مشتق از سرطان انسان سنتز کردند و سپس سلول ها را در معرض نور سبز با طول موج تقریبی 550 نانومتر قرار دادند.
انقباض ناشی از قلیایی شدن سلول های HeLa انسانی که در pH 9.0 کشت شده بودند به طور قابل توجهی توسط AR3 فعال شده با نور تسریع شد. محققان مشاهده کردند که بیشتر سلول ها در عرض سه ساعت تحت آپوپتوز قرار گرفتند.
محقق Shin Nakao، یکی از دانشجویان سودو، آزمایشی موازی انجام داد که در آن شرایط pH اعمال شده روی سلول ها در pH فیزیولوژیکی خنثی 7.4 بود. یک تجزیه و تحلیل بیوشیمیایی نشان داد که قلیایی شدن داخل سلولی ناشی از AR3 مسیر سیگنالینگ آپوپتوز میتوکندری را تحریک می کند که منجر به مرگ سلولی همراه با تغییرات مورفولوژیکی می شود.
PH اندازه گیری غلظت یون هیدروژن در یک محیط است و به عنوان شاخص اسیدیته، خنثی بودن و قلیاییت استفاده می شود. سودو گفت: "من فکر می کردم که آزمایش رویکرد ما قطعا نمی تواند در شرایط خنثی انجام شود." سلولها وقتی در محلول قلیایی خیسانده میشوند میمیرند و من فکر کردم که آیا میتوان این فرآیند را با استفاده از AR3 تسریع کرد. بنابراین، من فقط در pH 9 (قلیایی) آزمایش کردم. با این حال، دانشآموز آزمایشی را با pH 7 (خنثی)، یعنی شرایطی که معمولاً در بدن انسان رخ میدهد، انجام داد.
در PH خنثی، مشاهده نتایج در مدت زمان طولانیتری ضروری بود، اما آزمایش در نهایت موفق شد. سودو گفت: "اگر استراتژی ما در pH خنثی عمل کند، می توان از آن برای توسعه درمان استفاده کرد."
ناکائو افزود: «من میخواستم شرایط را برای بیماران قابل اجرا کنم، کاری که در pH 9 قابل انجام نیست. "بنابراین، من رویکردمان را در pH 7 امتحان کردم. این اتفاق افتاد، بنابراین خوشحالم که آن را امتحان کردم."
سپس محققان رویکرد خود را در آزمایشهای in vivo آزمایش کردند. آنها AR3 را روی نورون های حسی C. elegans سنتز کردند و فقط سلول های عصبی را هدف قرار دادند. هنگامی که بدن C. elegans در معرض نور سبز قرار گرفت، تنها نورونهایی که AR3 را سنتز میکنند، واکنش حسی کاهشیافتهای به مواد شیمیایی نشان دادند. به نظر میرسد که یونهای هیدروژن توسط AR3 از این نورونها پمپ شده و باعث قلیایی شدن سلولها و مرگ آنها شده است.
بر اساس این نتایج، محققان به این نتیجه رسیدند که AR3 میتواند باعث آپوپتوز در سلولهای هدف در هنگام قرار گرفتن در معرض نور شود.
محققان رویکرد خود را در قلیاییسازی سلولها با روشی که واکسن پیامرسان RNA (mRNA) برای COVID-19 کار میکند، مقایسه میکنند. همانطور که mRNA برای سنتز پروتئین های لازم به سلول ها تزریق می شود، ژن های AR3 باید به سلول های سرطانی وارد شوند تا سلول ها بتوانند AR3 را سنتز کنند. نشانگرهای ژنتیکی را می توان تنها برای سنتز AR3 در سلول های هدف استفاده کرد.
سودو گفت: "با استفاده از روش آپوپتوز سلولی القا شده توسط نور، که در آن AR3 فقط در سلول های سرطانی انسان سنتز می شود، می توان سلول های بیمار را بدون ایجاد واکنش های نامطلوب در سلول های سالم اطراف از بین برد."
این گروه گفت که قصد دارد روی بافت پستانداران آزمایش کند. رویکرد محققین به آپوپتوز ناشی از عکس پتانسیل بهعنوان یک ابزار اپتوژنتیک برای از بین بردن انتخابی سلولهای هدف با وضوح فضایی و زمانی بالا دارد.
برخی از مردم ممکن است فکر کنند که چون رویکرد ما سرطان را با نور از بین میبرد، مانند روشهای قبلی است. با این حال، استراتژی ما حول آپوپتوز به جای نکروز متمرکز است و بنابراین اساساً متفاوت است. سودو گفت: رویکرد ما میتواند به روشهای درمانی کاملاً جدید منجر شود.
پوشش تحت تابش نور، درمان چاقی غیر جراحی را افزایش می دهد
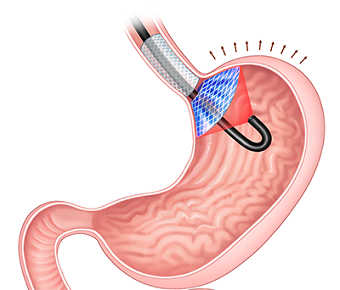
یک تیم تحقیقاتی چند مؤسسه ای در کره جنوبی عملکرد موجود ایمپلنت های سرکوب کننده اشتها در معده را با درمان فتودینامیک تقویت کرده اند و روی چنین ایمپلنتی را با رنگ فعال شده با نور می پوشانند که سلول های تولید کننده گرلین را که به عنوان "هورمون گرسنگی" شناخته می شود، می کشد. محققان در این کار از دستگاه های القا کننده سیری داخل معده یا ISD استفاده کردند و پوشش دادند. محققان در کار فعلی این ایمپلنت ها را در سال 2019 طراحی و معرفی کردند.
ایمپلنت های سرکوب کننده اشتها که می توانند مانند بادکنک های مینیاتوری در معده عمل کنند، جایگزین های غیرجراحی برای درمان چاقی هستند. این ایمپلنت ها را می توان از طریق دهان وارد معده کرد. ISDها شامل یک استنت است که در قسمت تحتانی مری قرار می گیرد و به دیسکی متصل می شود که در دهانه معده قرار دارد. دیسک دارای سوراخی در مرکز خود است که به غذا اجازه عبور می دهد.
اگرچه آزمایشات روی خوک ها نشان داد که ISD ها با افزایش احساس سیری و کاهش سطوح گرلین، که توسط سلول های نزدیک بالای معده تولید می شود، مصرف غذا و افزایش وزن را کاهش می دهند، این دستگاه عوارضی از جمله رفلاکس اسید ایجاد کرد.
هدف کار فعلی سرکوب بیشتر گرلین با پوشش دادن یک ISD با ترکیبی بود که میتواند برخی از سلولهای تولیدکننده گرلین را در اثر برهمکنش نور از بین ببرد. طراحی محققان در این کار، حذف ایمپلنت برای جلوگیری از عوارض جانبی مرتبط با طراحی اولیه دستگاه بود.
ایمپلنت (آبی و خاکستری) با فشار دادن روی معده احساس سیری ایجاد میکند و هنگامی که توسط لیزر (سیاه) فعال میشود، سلولهایی را که گرلین تولید میکنند، به نام «هورمون گرسنگی» میکشد. تحقیقات در سال 2019 منجر به توسعه دستگاهی برای درمان چاقی به روش غیرجراحی شد، اما عوارض جانبی از جمله رفلاکس اسید به همراه داشت. با حسن نیت از ACS Applied Materials & Interfaces.
محققان ISD ها را با متیلن بلو پوشاندند که یک داروی حساس کننده نور و تایید شده توسط FDA است. سپس آنها را در شکم خوک های جوان قرار دادند. هنگامی که آنها ISD های پوشش داده شده را در معرض نور لیزر قرار دادند، این پوشش اکسیژن منفرد را آزاد کرد که سلول های تولید کننده گرلین را که در نزدیکی آن قرار داشتند از بین برد و سپس به سرعت ناپدید شد.
پس از یک هفته، این درمان سلولهای گرلین و افزایش وزن بدن را در مقایسه با خوکهای درماننشده به نصف کاهش داد، اگرچه محققان گفتند که این تفاوتها در هفتههای بعد کاهش مییابد مگر اینکه درمان با نور تکرار شود. با این حال، با توسعه بیشتر، آنها بر این باورند که این روش می تواند به یک درمان کم تهاجمی برای کمک به کاهش وزن بیماران چاق تبدیل شود.
نویسندگان مقاله توسط کمک هزینه توسعه تجهیزات پزشکی کره که توسط دولت کره تامین می شود، حمایت شدند.
مجله بیوفوتونیک
مجله بیوفتونیک
محدوده
مجله بیوفوتونیک اولین مجله بینالمللی است که به انتشار مقالات و نقدهای اصلی از حوزه هیجانانگیز بیوفوتونیک، یعنی توسعه و کاربرد فناوریهای فوتونیک بهویژه برای (زیست) پزشکی، و همچنین علوم زیستی و محیطی اختصاص دارد. این مجله بستری را ارائه می دهد که توسعه دهندگان فناوری (فیزیکدانان، شیمیدانان، مهندسان، و غیره) با استفاده کنندگان نهایی (به ویژه پزشکان تحقیقاتی) ارتباط برقرار می کنند و در آن پزشک بالینی در مورد آخرین ابزارهای تشخیص و درمان بیماری ها می آموزد. به این ترتیب، این مجله بسیار میان رشته ای است و پژوهش های نوآورانه ای را در زمینه تعامل نور با مواد بیولوژیکی منتشر می کند. این پوشش از تحقیقات بنیادی تا پیشرفتهای خاص را شامل میشود، در حالی که شامل آخرین برنامهها یا کارآزماییهای بالینی/گزارشهای موردی نیز میشود.
موضوعات
زمینه های کاربرد:
دارو
سلامتی
زیست شناسی
محیط زیست و تغذیه
فناوری های ویژه:
میکروسکوپی / تصویربرداری / آندوسکوپی
(به عنوان مثال میکروسکوپ عمومی، تصویربرداری فلورسانس، میکروسکوپ ارتعاشی، توموگرافی انسجام نوری، تصویربرداری فوتوآکوستیک، میکروسکوپ میدان نزدیک و غیره)
طیف سنجی
(IR، رامان، اپتیک منتشر، فلورسانس، لومینسانس، THz، UV/Vis، پراکندگی نور و غیره)
رویکردهای درمانی فوتونیک
(PDT، جراحی لیزر، LIBS، انعقاد عکس و غیره)
نقطه مراقبت فوتونیک
(بیوچیپ، سنجش زیستی، فناوری میکرو آرایه و غیره)
هوش مصنوعی
(به عنوان مثال تجزیه و تحلیل تصویر، پردازش تصویر، شیمی سنجی و غیره)
پیشرفت در طیفسنجی فیبر نوری رامان بلادرنگ برای تشخیص زودهنگام سرطان: فشار دادن مرز به برنامههای آندوسکوپی بالینی
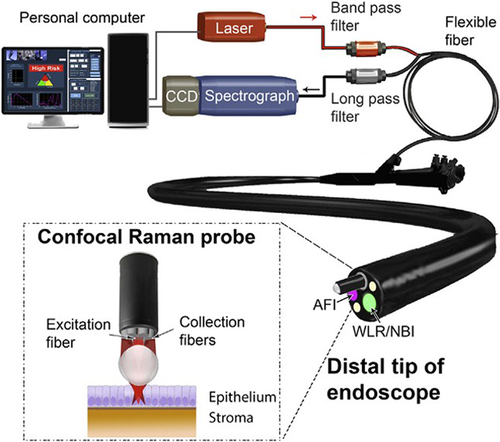
آندوسکوپهای انعطافپذیر [1] بر اساس بازتاب نور سفید (WLR) استاندارد مراقبت برای تشخیص سرطان و نظارت بر پیش سرطان در اندامهای داخلی است [2]. با این حال، یک چالش بالینی در تشخیص ضایعات پیش بدخیم و تغییرات اولیه نئوپلاستیک نهفته است. تکیه بر معیارهای تشخیصی بصری ذهنی (یعنی جزئیات ساختاری و مورفولوژیکی بافت) منجر به دقت تشخیصی ضعیف به دلیل فقدان تغییرات مورفولوژیکی آشکار مرتبط با دگرگونی نئوپلاستیک اولیه، حتی در دستان آندوسکوپیست های مجرب می شود [3]. تصویربرداری اتوفلورسانس (AFI) [4-6] و تصویربرداری باند باریک (NBI) [6، 7] برای بهبود تشخیص سرطان با مشاهده فلوروفورهای درون زا در بافت و افزایش کنتراست تصویر ریز عروقی بافت ایجاد شدهاند، اما این میدان وسیع است. روشهای تصویربرداری هنوز از ویژگیهای تشخیصی متوسطی به دلیل وابستگی بین مشاهدهگر و عدم توانایی آشکارسازی اطلاعات بیومولکولی خاص در مورد بافت رنج میبرند. توسعه فنآوریهای نوری پیشرفته کمتهاجمی یا غیرتهاجمی مبتنی بر امضاهای زیست مولکولی ذاتی سلولها و بافتها، سنگ بنای تشخیص آندوسکوپی است. نمونهبرداریهای نوری هدفمند برای کاوش بافت پرخطر در محل میتواند تا حد زیادی خطاهای نمونهبرداری تصادفی بیوپسی و همچنین هزینههای مراقبتهای بهداشتی و بار بیماران را کاهش دهد.
طیفسنجی رامان یک تکنیک ارتعاشی نوری منحصر به فرد است که قادر به بررسی ساختارهای مولکولی خاص و ترکیبات بافتی است و فرصتهای جدیدی برای تشخیص زودهنگام پیش سرطان و سرطان در انسان ایجاد میکند. فیزیکدان هندی سر چاندراساخارا ونکاتا رامان (1888-1970) با الهام از رنگ آبی عمیق دریای مدیترانه در طول سفر دریایی به اروپا در سال 1921 و کشف اثر کامپتون [8] (جایزه نوبل 1927)، "رامان" را کشف کرد. اثر» (1928) [9]، و متعاقباً جایزه نوبل فیزیک را در سال 1930 دریافت کرد. هنگامی که فوتون های فرودی باعث تغییر قطبش در یک مولکول می شوند، بخش کوچکی از فوتون های فرودی (~1 در 10 [8]) پراکنده می شوند. تغییر در فرکانس [10]. انرژی جذب شده مربوط به حالتهای ارتعاشی فعال رامان مولکولها است، و نور پراکنده شده، اثرانگشت (FP) منحصربهفردی از مولکولها را در نمونهها حمل میکند. با استفاده از لیزرهای مادون قرمز نزدیک (NIR) به عنوان منابع نور تحریک، طیفسنجی رامان NIR دارای مزایای قابل توجهی در کاربردهای زیست پزشکی است، زیرا آب در محدوده طول موج کاری NIR جذب بسیار پایینی دارد و بافتها اتوفلورسانس (AF) بسیار کمتری نسبت به استفاده کوتاهتر نشان میدهند. تحریک نور مرئی [11]. جذب آب کمتر به دلیل نفوذ عمیق نور به بافت، تشخیص اجزای بافت را آسان می کند. مطالعات اولیه به طور گسترده از طیفسنجی تبدیل فوریه رامان تحت تحریک NIR برای توصیف نمونههای بافتی مختلف، مانند بافتهای زنان [12]، مغزها [13، 14]، شریانها [15، 16]، پوست [17-20] بافت دهان [21] استفاده کردهاند. ] و غیره. با این حال، زمانهای طولانی اکتساب (حداکثر 10-35 دقیقه)، و تنظیمات نوری حجیم طراحیهای اولیه سیستم رامان، موانعی برای تشخیص پزشکی معمول در داخل بدن بودند. پیشرفتهای فنی اخیر در لیزرهای دیود فشرده NIR، طیفنگارهای تصویربرداری رامان با کارایی بالا با گریتینگهای هولوگرافی، دوربین دستگاه همراه با شارژ عمیق (CCD)، فیلترهای بریدگی/فیلترهای رامان با لبههای تیز و طرحهای مینیاتوری پروب رامان فیبر نوری کسب سریع طیف های رامان بافت NIR در محیط های بالینی را مجاز کرده اند [22-24]. شواهد انباشتهای از طیفسنجی رامان NIR برای شناسایی و تشخیص بافت در تعدادی از مکانهای اندام (مانند پوست [25-28]، پستان [29-31]، حفره دهان [32]، حنجره/نازوفارنکس [33-36] گزارش شده است. ]، مری و معده [37-41]، کولون [37، 42]، ریه [11، 43، 44]، مثانه [45-51]، پروستات [37، 49، 52]، دهانه رحم [53، 54]، مغز [48، 55-58]، استخوان [59، 60]، شریان [61، 62] و غیره). با تشویق نتایج امیدوارکننده مطالعات ex vivo Raman و همچنین آخرین پیشرفت در فنآوریهای NIR Raman، پیشرفت قابل توجهی در ترجمه طیفسنجی NIR Raman به کاربردهای آندوسکوپی in vivo در زمان واقعی حاصل شده است. در حال حاضر، شواهد رو به رشد قابل توجهی وجود دارد که نشان می دهد طیف سنجی رامان فیبر نوری دارای قابلیت تشخیص سریع و مشخص کردن بافت ها در داخل بدن، به روشی بدون برچسب و غیر مخرب است. این مقاله ابزار دقیق رامان بالینی پیشرفته، پیشرفتها در پروبهای آندوسکوپی رامان فیبر نوری، پیش پردازش طیفی، استخراج ویژگیهای پیشرفته و الگوریتمهای طبقهبندی مورد استفاده در طیف رامان برای تشخیص زودهنگام بیماری را بررسی میکند. دو دهه گذشته کار آندوسکوپی رامان خلاصه میشود، پیشرفتهای اخیر در هوش مصنوعی و یادگیری ماشین در طیفسنجی رامان زیستپزشکی برجسته میشود، و یافتههای زیستپزشکی از آخرین مطالعات بالینی in vivo نیز برای نشان دادن پتانسیل بزرگ مورد تاکید قرار میگیرد.
پیشرفت در طیفسنجی فیبر نوری رامان بلادرنگ برای تشخیص زودهنگام سرطان: فشار دادن مرز به برنامههای آندوسکوپی بالینی

ابزار دقیق رامان مدرن برای اندازه گیری و تشخیص رامان بالینی در زمان واقعی و in vivo. سیستم رامان شامل یک کاوشگر فیبر نوری با تفکیک عمق است که میتواند در کانال ابزار یک آندوسکوپ پزشکی قرار گیرد، یک طیفسنج حساس رامان که میتواند هم اثر انگشت و هم اطلاعات طیفی با تعداد موج بالا را بهطور همزمان به دست آورد، و یک الگوریتم یادگیری ماشینی قوی برای ارائه تشخیص دقیق رامان در زمان واقعی در آندوسکوپی.
توموگرافی انسجام نوری برای طبقه بندی بافت حنجره در یک محیط سرپایی - یک چالش ترجمه در آستانه حل؟
بیوپسی نوری سرطان حنجره توسط توموگرافی همدوسی نوری هدایت شده آندوسکوپی (OCT) همراه با روش های یادگیری عمیق: یک تصویر OCT یا ویدیو ابتدا از قبل پردازش شده و سپس با تکنیک های یادگیری عمیق مانند شبکه های عصبی کانولوشنال تجزیه و تحلیل می شود. خروجی نهایی می تواند بافت را به گروه های مختلفی طبقه بندی کند که از تصمیم پزشک حمایت می کند.
شناخت ویروس ها و عفونت های ویروسی با روش های بیوفتونیک
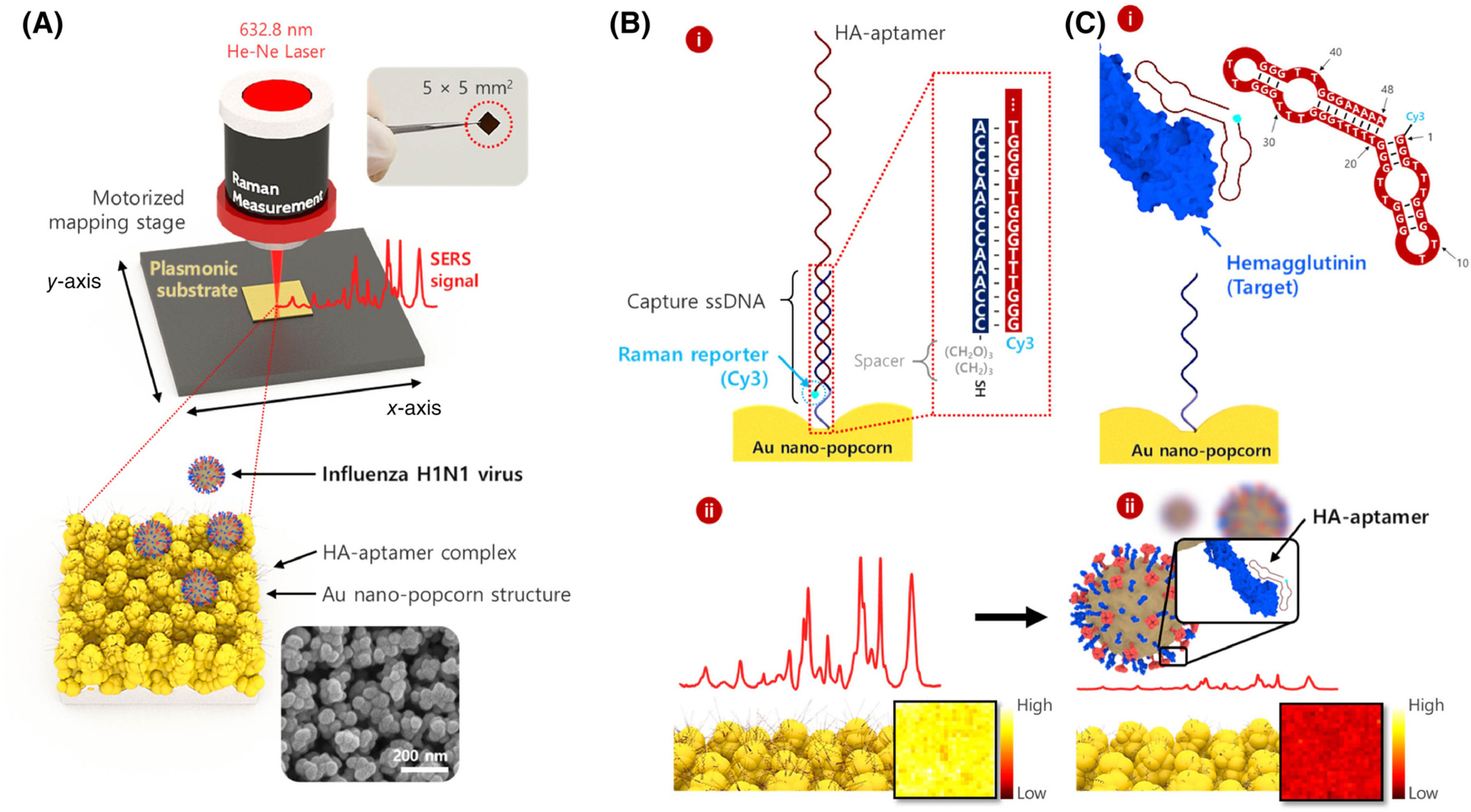
(الف) نمودار شماتیک تصویربرداری و طیفسنجی فتوترمال فروسرخ میانی تداخل سنجی هم کانونی (MIP)، (B) تصویر پراکندگی تداخل سنجی یک ویروس آبله منفرد، تصویر MIP از همان ویروس آبله در (C) 1550 cm-1 و (D) در 1650 cm-1، (E) به طور مثال طیف MIP از چهار ویروس آبله مختلف.
شناخت ویروس ها و عفونت های ویروسی با روش های بیوفتونیک
خلاصه
در چند دهه اخیر، شیوع عفونتهای ویروسی اغلب زیرساختهای بهداشتی در سراسر جهان را به چالش کشیده و علیرغم پیشرفت در فناوریهای تشخیصی، بار مالی قابلتوجهی و همچنین رنج انسانی را به همراه داشته است. شیوع اخیر ویروس ابولا در قاره آفریقا، ویروس زیکا در قاره آمریکا، سندرم حاد تنفسی (SARS)، سندرم تنفسی خاورمیانه (MERS)، آنفولانزای A و اخیراً سندرم حاد تنفسی ویروس کرونا 2 (SARS-CoV) -2) عفونت های ویروسی بارها و بارها اهمیت پیشرفت تکنولوژی را برجسته کرده اند که درک بهتر ویریون ها را ممکن می سازد. در این بررسی، ما به طور سیستماتیک جنبههای مختلف ویریونها و چگونگی بررسی خواص و عملکردهای آنها را با استفاده از فناوریهای مختلف مبتنی بر نور مورد بحث قرار میدهیم. ما بر طبقه بندی ویریون، تشخیص و تعامل با سیستم ایمنی میزبان تمرکز می کنیم. علاوه بر این، پتانسیل روشهای بیوفتونیک پیشرفته، به عنوان مثال، رامان، بازتاب مادون قرمز، طیفسنجی جذب و فلورسانس، تکنیکهای میکروسکوپی پیشرفته و رویکردهای مبتنی بر حسگر زیستی برای تشخیص عفونتهای ویروسی، بررسی درمانها و توسعه واکسن شرح داده شده است. اگرچه پیشرفتهای قابل توجهی قبلاً در فناوریهای فوتونیک انجام شده است، که حتی امکان تجسم تعاملات ویریون-میزبان را در سطح تک سلولی فراهم میکند، تکامل مداوم ویروسها نیازمند پیشرفت بیشتر در راهحلهای بیوفوتونی برای دستگاههای نظارت بر سلامت سریع، مقرونبهصرفه و قوی برای غربالگری عفونتهای ویروسی است.
میکروسکوپ جذبی تشدید کننده فوتونیک
میکروسکوپ جذبی تشدید کننده فوتونیک
کریستال های فوتونیک تشدید کننده های نوری هستند که به طور گسترده برای میکروسکوپ با وضوح دیجیتال و سنجش زیستی مورد بررسی قرار می گیرند [42، 43]. بلورهای فوتونیک دارای آرایش تناوبی هستند که دارای گذردهی دی الکتریک هستند که به عنوان یک آنالوگ نوری برای پتانسیل اتمی الکترون ها عمل می کند [44]. طول موجهای تشدید با دستکاری میدانهای الکترومغناطیسی مرتبط با نور ساطع شده از کریستالهای فوتونیک تولید میشوند. به این ترتیب، یک موج ایستاده الکترومغناطیسی که شدت های نسبت به شدت منبع نور روشن کننده را نشان می دهد تولید می شود [45-47]. علاوه بر این، نشان داده شده است که نانوذرات طلا (AuNP) با رزونانس پلاسمون سطح موضعی (LSPR) با میدان الکترومغناطیسی تشدید کننده یک کریستال فوتونی همپوشانی دارند، که منجر به تقویت قابل توجه راندمان جذب میشود [48]. این ترکیبی از نانوذرات طلا و سطح بلورهای فوتونیک، مشاهده تک تک نانوذرات طلا را با میکروسکوپ نوری معکوس معمولی امکان پذیر می کند. در این روش، جذب نانوذرات افزایش یافته، نوری را که به درون هدف میکروسکوپ منعکس میشود، کاهش میدهد. میکروسکوپ جذبی تشدید کننده فوتونیک نوعی میکروسکوپ حسگر زیستی است که از جفت تشدید کریستال های فوتونی-AuNP استفاده می کند [49-51]. همانطور که توسط Canady و همکارانش اشاره شد، شدت نور منعکس شده از بلورهای فوتونی در حضور هر نانوذره زمانی که طول موج تشدید پلاسمون سطحی نانوذره با طول موج تشدید بلور فوتونی مطابقت داشته باشد، به صورت موضعی خاموش می شود [49]. آنها حساسیت فوق العاده (<1 بعد از ظهر) و همچنین انتخاب عدم تطابق تک پایه و حد تشخیص 100-aM را از طریق سنجش تمایز جنبشی نشان دادند [49]. چن و همکاران استفاده از یک رویکرد وضوح زیر میکرونی بدون برچسب به نام میکروسکوپ افزایشیافته کریستال فوتونی را مورد مطالعه قرار دادند که از سطح حسگر زیستی کریستال فوتونی به عنوان بستری برای اتصال سلولی برای درک اتصال و مورفولوژی سلولهای بنیادی دندانی موش استفاده میکند. مطالعه مرور زمان شامل کموتاکسی با یک شیمیکشنده در شکل 4 نشان داده شده است [46]. ژائو و همکاران استفاده از یک بیوسنسور نوری کریستال فوتونی پوشش داده شده با پروتئین نوترکیب سنبله را برای تشخیص کمی سطح IgG سرولوژیکی انسان در برابر ویروس SARS-CoV-2 مطالعه کردند. این رویکرد تک مرحلهای و بدون شستشو از نانوذرات طلای عاملدار شده با آنتیبادی استفاده میکند که مجتمعهای ایمنی ساندویچی را تشکیل میدهند. رویکردی به نام «کنترل فعال + شمارش دیجیتال» (AC + DC) تشخیص 100 pg mL-1 از COVID-19 IgG انسانی را در نمونههای سرم در طی یک سنجش 15 دقیقهای امکانپذیر کرد [50]. Ghosh و همکارانش استفاده از میکروسکوپ جذبی تشدید کننده فوتونی را با روشنایی از یک نور پلاریزه که از یک LED قرمز با شدت کم ساطع میشود و تشخیص با یک سنسور تصویر CMOS ارزان قیمت برای مراقبتهای زیستی ارزان قیمت توصیف کردند. آنها تشخیص توالی های miRNA را با محدودیت تشخیص 160 صبح با زمان سنجش 30 دقیقه نشان دادند [52].
توموگرافی کامپیوتری با گسیل تک فوتون
توموگرافی کامپیوتری با گسیل تک فوتون
با پیشرفت در تشخیص مولکولی و رادیولوژیکی، توموگرافی کامپیوتری گسیل تک فوتون (SPECT) یکی از تکنیک های تصویربرداری قدرتمند برای بررسی جریان خون به بافت ها و اندام ها در نظر گرفته می شود. این یک تکنیک تصویربرداری هسته ای است که توموگرافی کامپیوتری و استفاده از ردیاب های رادیواکتیو را ترکیب می کند. دومی به تشخیص جریان خون به اندام ها برای تشخیص عفونت ها، تومورها، تشنج و سایر شرایط پزشکی کمک می کند [32]. به طور معمول، فلوئور-18، ید-123، تالیم-201 و زنون-133 ایزوتوپ های رادیویی مورد استفاده در این تکنیک هستند. داس و همکاران نشان دادند که توموگرافی کامپیوتری با انتشار تک فوتون پرفیوژن (Q) در تشخیص آمبولی ریه در یک گروه شش نفره از بیماران مبتلا به عفونت SARS-CoV-2 مفید بود [31]. Vöö و Dizdarevic اشاره کردند که ادغام SPECT با توموگرافی کامپیوتری با دوز پایین برای تشخیص حوادث ترومبوآمبولیک وریدی در بیماران COVID-19 مفید است. فقط پرفیوژن SPECT ممکن است در بیماران حامله COVID-19 استفاده شود [33]. Cobes و همکاران نشان دادند که SPECT با توموگرافی کامپیوتری با دوز پایین ممکن است برای تشخیص آمبولی ریه در بیماران تحت درمان پنومونی COVID-19 از طریق مشاهده ناهنجاریها در تهویه و پرفیوژن استفاده شود [34].