
Sepanta Laser Spadan
شرکت سپنتا لیزر اسپادان سهامی خاص
Sepanta Laser Spadan
شرکت سپنتا لیزر اسپادان سهامی خاصعلوم اعصاب/میکروسکوپی/اپتوژنتیک
علوم اعصاب/میکروسکوپی/اپتوژنتیک: فناوری های جدید برای تصویربرداری عصبی در علوم اعصاب
صنعت نوروتکنولوژی - شامل دستگاهها، تشخیصها و داروهایی است که مغز و بقیه سیستم عصبی را هدف قرار میدهند.
میکروسکوپ
یک میکروسکوپ فلورسانس مینیاتوری و یکپارچه به نام nVista HD اولین بار در این رویداد به نمایش درآمد. توسعهدهنده اینسکوپیکس، شرکت (پالو آلتو، کالیفرنیا) این سیستم را بر اساس فناوری توسعهیافته در دانشگاه استنفورد استوار کرد: nVista HD امکان پخش ویدیوهای زنده و با کیفیت بالا از فعالیتهای عصبی در مقیاس بزرگ را در موشهای بیدار و دارای رفتار طبیعی فراهم میکند.
دستگاه های مولکولی (سانی ویل، کالیفرنیا) نسخه 2.5 نرم افزار اتوماسیون میکروسکوپی و تجزیه و تحلیل تصویر MetaMorph NX خود را به نمایش گذاشت که شامل ماژول هایی برای بررسی مورفولوژی عصبی و ساختارهای فیبر، پشتیبانی از دستگاه های روشنایی هدفمند، و حالت گرفتن تصویر با سرعت بالا است.
شرکتهای میکروسکوپی سنتیتر نیز سیستمها و قابلیتهای جدیدی را منتشر کردند. به عنوان مثال، گروه تجاری میکروسکوپی کارل زایس (ینا، آلمان) Lightsheet Z.1 خود را معرفی کرد، یک سیستم میکروسکوپ فلورسانس ورقه نور (LSFM) برای تصویربرداری از فرآیندهای پویا در نمونه های زنده. اصل روشنایی سیستم، سمیت نوری بسیار کم و انکوباسیون یکپارچه را ارائه می دهد تا تصویربرداری را در طول ساعت ها یا چند روز یا بیشتر امکان پذیر کند. به خصوص در مورد ارگانیسم های بزرگتر، مانند مگس میوه یا جنین گورخرماهی، این رویکرد اطلاعات بیشتری نسبت به میکروسکوپ فلورسانس سنتی ارائه می دهد. و می تواند داده ها را از زوایای دید مختلف تولید کند که می تواند در بازسازی های سه بعدی و ویدیوهای تایم لپس ترکیب شود.
میزبان سمپوزیومی بود که پیشرفتها در تصویربرداری عملکردی و نقشهبرداری مغز در سطح میکروسکوپی، از جمله قابلیت جدید میدان تاریک با کنتراست بالا سیستم میکروسکوپ اسلاید مجازی VS120 را برجسته کرد. هم برای نمونههای رنگآلود و هم برای نمونههای فلورسنت، تاریکفیلد درک ساختار و عملکرد را تسهیل میکند و سودمندی خاصی برای تصویربرداری مغز را نوید میدهد.
لایکا میکروسیستمز (وتزلار، آلمان) سیستم کانونی چند فلورسانس طیفی مبتنی بر منشور TCS SP8 جدید خود را با اسکن با سرعت بالا تا 428 فریم در ثانیه برجسته کرد. این دوربین میدان دید وسیع و انباشته شدن سریع Z را ارائه می دهد و اجزای نوری آن برای تقویت کنتراست و بهبود زنده ماندن در تصویربرداری سلول زنده طراحی شده اند.
استفاده از اپتوژنتیک برای درمان بیماری پارکینسون
استاندارد طلایی برای درمان بیماری پارکینسون دارو است. ترکیب موجود در این دارو، که قوی ترین دارو برای بیماری پارکینسون است، با افزایش سطح دوپامین در مغز، علائم کلیدی این بیماری مانند سفتی و کندی حرکت را کاهش می دهد. با این حال، این دارو عوارض جانبی عمده ای مانند دیسکینزی و ایجاد رفتارهای تکانشی دارد. تأثیر دارو نیز به مرور زمان از بین می رود.
با توجه به اینکه تخمین زده می شود بیش از 10 میلیون نفر در سراسر جهان با بیماری پارکینسون زندگی می کنند، نیاز فوری به درمان موثرتر وجود دارد. درمان جایگزین فعلی، درمان جراحی با تحریک عمیق مغز است که نویدبخش است. با این حال، تنها بخش کوچکی از بیماران پارکینسون این درمان را دریافت می کنند.
مطالعات نشان داده اند که تحریک عمقی مغز می تواند به طور موثری اختلال حرکتی را درمان کند و همچنین نشان داده است که در گسترش پنجره موثر موثر است. در حالی که این درمان بدون عوارض جانبی، مانند موارد مربوط به خلق و خو و شناخت نیست، درمان تحریک مغز یک حوزه درمانی امیدوارکننده برای کشف است.
اکنون دانشمندان در تلاش هستند تا درمان تحریک مغز را از طریق استفاده از اپتوژنتیک بهینه کنند. این فرضیه وجود دارد که اپتوژنتیک می تواند شکاف های مهمی را در دانش ما از بیماری پارکینسون روشن کند تا دانشمندان بتوانند یک گزینه درمانی پیشرفته و خاص برای بیمار ارائه دهند.
قبل از اینکه اپتوژنتیک به پتانسیل کامل خود برسد، تحقیقات بیشتری در این زمینه مورد نیاز است. در سالهای آتی، احتمالاً شاهد پیشرفتهای مهم تری از مطالعات با استفاده از دستگاههای اپتوژنتیک قابل کاشت خواهیم بود، که احتمالاً در ابتدا حوزه بیماریهای عصبی بیشترین سود را خواهد داشت.
پیشرفت تحقیقات پزشکی با دستگاه های اپتوژنتیک قابل کاشت
اپتوژنتیک یک رشته نوظهور است که از نور و مهندسی ژنتیک برای شناسایی و کنترل فعالیت پروتئین ها یا نورون های اصلاح شده ژنتیکی استفاده می کند.
کار در زمینه اپتوژنتیک چندین دهه پیش آغاز شد، با این حال، در سال 2002 زمانی که زملمن و همکارانش روشی را برای فعال کردن گروههایی از نورونهای حساس به رودوپسین از طریق تحریک نوری ایجاد کردند، اولین پیشرفت خود را در علوم اعصاب جریان اصلی ایجاد کرد. از آن زمان، دانشمندان به طور فزاینده ای به حوزه اپتوژنتیک علاقه مند شده اند و تحقیقات زیادی برای استفاده از آن در کاربردهای متعدد انجام شده است.
اپتوژنتیک کاربردهای متعددی را در بخشهای مختلف، از فناوری گرفته تا کشاورزی، توسعه داده است. در اینجا، ما بر چگونگی تحول در تحقیقات پزشکی برای تسهیل تشخیص سریع بیماری و ارائه نظارت و گزینه های درمانی جدید برای بیماری های مختلف تمرکز می کنیم.
نوروفیدبک
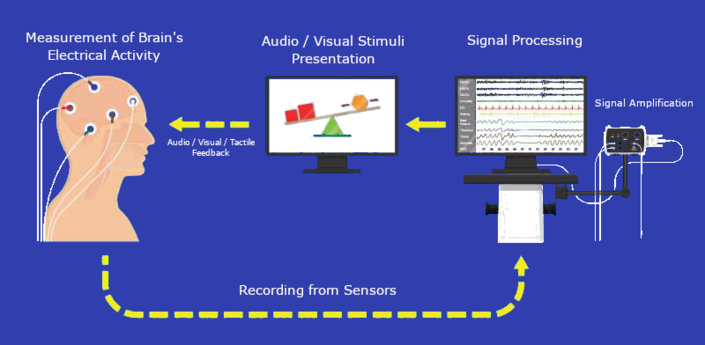
نوروفیدبک (NFB) که نوروتراپی نیز نامیده میشود، نوعی بیوفیدبک است که بازخوردی را در زمان واقعی از فعالیت مغز ارائه میکند تا عملکرد سالم مغز را از طریق شرطیسازی عملی تقویت کند. به طور معمول، فعالیت الکتریکی از مغز از طریق حسگرهایی که با استفاده از الکتروانسفالوگرافی (EEG) روی پوست سر قرار میگیرند، جمعآوری میشود و بازخورد با استفاده از نمایشگرهای ویدئویی یا صدا ارائه میشود. شواهد قابل توجهی وجود دارد که از نوروتراپی برای درمان عمومی اختلالات روانی حمایت می کند، [1] [2] و در طول چهار دهه انجام شده است، اگرچه هرگز در جریان اصلی پزشکی برجسته نشده است. NFB نسبتا غیر تهاجمی است و به عنوان یک گزینه درمانی طولانی مدت تجویز می شود که معمولاً یک ماه طول می کشد تا تکمیل شود.
چندین پروتکل نوروفیدبک وجود دارد که مزایای بیشتری از استفاده از الکتروانسفالوگرافی کمی (QEEG) یا تصویربرداری تشدید مغناطیسی عملکردی (fMRI) برای محلیسازی و شخصیسازی درمان دارد.[3][4] فناوریهای مرتبط شامل نوروفیدبک با واسطه طیفسنجی فروسرخ نزدیک (fNIRS)، بیوفیدبک هموآنسفالوگرافی (HEG) و بیوفیدبک fMRI است.
استفاده پزشکی الکتروانسفالوگرافی
الکتروانسفالوگرافی
الکتروانسفالوگرافی (EEG) روشی برای ثبت الکتروگرام از فعالیت الکتریکی روی پوست سر است که نشاندهنده فعالیت ماکروسکوپی لایه سطحی مغز در زیر آن است. معمولاً غیر تهاجمی است و الکترودها در امتداد پوست سر قرار می گیرند. الکتروکورتیکوگرافی، شامل الکترودهای تهاجمی، گاهی اوقات EEG داخل جمجمه نامیده می شود.
EEG نوسانات ولتاژ ناشی از جریان یونی در نورون های مغز را اندازه گیری می کند.[1] از نظر بالینی، EEG به ثبت فعالیت الکتریکی خود به خودی مغز در طول یک دوره زمانی اشاره دارد، همانطور که از چندین الکترود قرار داده شده بر روی پوست سر ثبت شده است.[1] کاربردهای تشخیصی عموماً بر روی پتانسیل های مرتبط با رویداد یا بر محتوای طیفی EEG تمرکز دارند. اولی نوسانات بالقوه زمان قفل شده برای یک رویداد را بررسی می کند، مانند "شروع محرک" یا "فشار دکمه". دومی نوع نوسانات عصبی (که معمولاً "امواج مغزی" نامیده می شود) را که می توان در سیگنال های EEG در حوزه فرکانس مشاهده کرد، تجزیه و تحلیل می کند.
EEG اغلب برای تشخیص صرع استفاده می شود که باعث ناهنجاری در خواندن EEG می شود.[2] همچنین برای تشخیص اختلالات خواب، عمق بیهوشی، کما، آنسفالوپاتی ها و مرگ مغزی استفاده می شود. EEG یک روش خط اول تشخیص برای تومورها، سکته مغزی و سایر اختلالات مغزی کانونی بود، [3] [4] اما این استفاده با ظهور تکنیکهای تصویربرداری آناتومیک با وضوح بالا مانند تصویربرداری تشدید مغناطیسی (MRI) کاهش یافته است. و توموگرافی کامپیوتری (CT). علیرغم وضوح فضایی محدود، EEG همچنان یک ابزار ارزشمند برای تحقیق و تشخیص است. این یکی از معدود تکنیک های موبایل موجود است و وضوح زمانی با برد میلی ثانیه ارائه می دهد که با CT، PET یا MRI امکان پذیر نیست.
مشتقات تکنیک EEG شامل پتانسیلهای برانگیخته (EP) میشود که شامل میانگینگیری فعالیت EEG در زمان ارائه یک نوع محرک (بصری، حسی، جسمی یا شنوایی) است. پتانسیلهای مرتبط با رویداد (ERP) به پاسخهای EEG متوسطی اشاره دارد که برای پردازش پیچیدهتر محرکها قفل شدهاند. این تکنیک در علوم شناختی، روانشناسی شناختی و تحقیقات روانی فیزیولوژیکی استفاده می شود.
ابزار اپتوژنتیک ارگانیک نور را بر ارتباطات مغز می تاباند

شفاف سازی بافت با استفاده از هیدروژل های مبتنی بر آکریل آمید
روشنی [1] روشی برای شفاف سازی بافت با استفاده از هیدروژل های مبتنی بر آکریل آمید است که از داخل ساخته شده و به بافت متصل شده است و همانطور که در مقاله اولیه تعریف شده است ، نشان دهنده "تبدیل بافت بیولوژیکی دست نخورده به شکل ترکیبی است که در آن اجزای خاصی با عناصر برون زایی جایگزین می شوند که دسترسی یا عملکرد جدیدی را ارائه می دهند ". [1] هنگامی که با برچسب گذاری بر اساس آنتی بادی یا ژن همراه است ، CLARITY تصاویری بسیار دقیق از ساختار پروتئین و اسید نوکلئیک اندام ها ، به ویژه مغز را قادر می سازد. این توسط Kwanghun Chung و Karl Deisseroth در دانشکده پزشکی دانشگاه استنفورد توسعه داده شد. [2]
چندین مقاله منتشر شده روش CLARITY را برای طیف وسیعی از بافتها و بیماریها مانند ایمونوآنکولوژی سرطان سینه انسان ، [3] مغز انسان در بیماری آلزایمر ، [4] نخاع موش ، [5] مدل حیوانی مولتیپل اسکلروزیس ، اعمال کرده اند. [6] و گیاهان. [7] CLARITY همچنین با فن آوری های دیگر ترکیب شده است تا روش های جدید میکروسکوپی از جمله میکروسکوپ انبساط کانونی ، میکروسکوپ ورق نور SPIM و میکروسکوپ ورق نور بهینه سازی شده با وضوح (COLM) ترکیب شود.
اپتوژنتیک: چراغ ها ، دوربین ، عمل! اشعه ای از نور ، سایه ای بدون نقاب
اپتوژنتیک: چراغ ها ، دوربین ، عمل! اشعه ای از نور ، سایه ای بدون نقاب
خلاصه:
زمینه اپتوژنتیک با سرعت زیادی پیشرفت کرده است و هم به عنوان یک ابزار تحقیقاتی و هم یک راه حل درمانی برای کاربردهای زیست پزشکی ، به ویژه در زمینه علوم اعصاب عمل می کند. با ابتکار اخیر BRAIN که توسط موسسه ملی سلامت راه اندازی شد و فناوری پیشرفته (به نام CLARITY) برای شفاف سازی مغز کل موش ، مفهوم استفاده از نور برای کاوش و کنترل عملکردهای سلولی به سرعت به واقعیت بالینی تبدیل می شود. با توجه به این واقعیت که کانالهای یونی حساس به نور (میکروبی) نیاز به ادغام در سلولهای حیوانی دارند ، پیش بینی می شود که کاربرد اپتوژنتیک تأثیر وسیعی بر بیوتکنولوژی ، علوم نانو و پزشکی داشته باشد. در این فصل ، ما به دنبال ارائه گزارشی عمیق از چشم انداز فعلی اپتوژنتیک ، کاربردهای بالینی بالقوه آن و پیامدهای آن در آینده هستیم.
