
Sepanta Laser Spadan
شرکت سپنتا لیزر اسپادان سهامی خاص
Sepanta Laser Spadan
شرکت سپنتا لیزر اسپادان سهامی خاصیک میکروسکوپ جدید امکان تصویربرداری اپتیکال تطبیقی سه بعدی با توان بالا را فراهم می کند
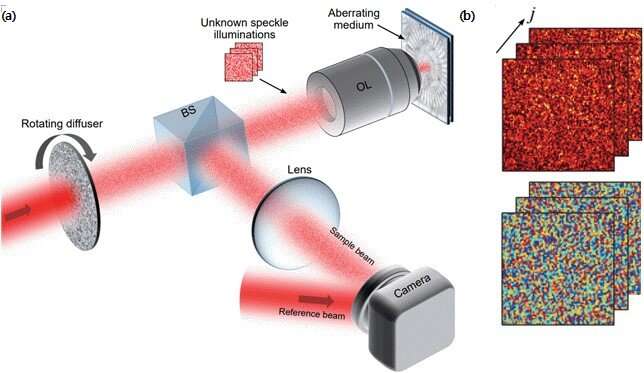
میکروسکوپ ها ابزار مهمی در تحقیقات زیست پزشکی هستند زیرا امکان مشاهده و تصویربرداری دقیق از بافت ها را فراهم می کنند. از آنجایی که مواد بیولوژیکی ذاتاً مات هستند، پراکندگی شدید نور هنگام عبور نور از بافتها رخ میدهد که باعث ایجاد سطح بالایی از نویز پسزمینه و انحراف نوری پیچیده میشود. بنابراین، میکروسکوپهای نوری معمولی عمدتاً به ما امکان دیدن سطح بافتها را میدهند و جزئیاتی که لایههای سلولی متعددی در اعماق آنها قرار دارند برای بسیاری از میکروسکوپها دور از دسترس هستند. این باعث می شود که گرفتن تصاویر نوری با وضوح بالا از ریزساختارها در عمق بافت ها بسیار چالش برانگیز باشد.
حدود یک سال پیش، یک گروه تحقیقاتی به سرپرستی پروفسور چوی وونشیک از مرکز طیفسنجی و دینامیک مولکولی (CMSD) در موسسه علوم پایه (IBS) یک تکنیک تصویربرداری به نام «میکروسکوپ ماتریس بازتاب» را به نمایش گذاشتند که ترکیبی از قدرتهای اپتیک تطبیقی پیشرفته سخت افزاری و محاسباتی. برخلاف تصویربرداری معمولی، یک ماتریس بازتابی را اندازه گیری می کند که حاوی تمام اطلاعات قابل دسترس در مورد رابطه بین فیلدهای ورودی و خروجی یک سیستم تصویربرداری، از جمله اشیاء مورد علاقه است. سپس میتوان یک تصویر واضح و بدون تحریف از شی را از ماتریس اندازهگیری شده با پردازش تصویر پس از دیجیتال استخراج کرد.
به این ترتیب، این فناوری به عنوان یک کاندید مناسب برای تصویربرداری نوری غیرتهاجمی بدون برچسب در عمق بافتهای بیولوژیکی ظاهر شد. تصویربرداری ماتریسی مطمئناً از اکثر AO های معمولی بهتر عمل می کند. به عنوان مثال، محققان نشان دادند که این فناوری به اندازه کافی قدرتمند است تا جمجمه دست نخورده موش را ببیند و امکان تصویربرداری دقیق از نورونهای زیر را فراهم کند.
کنترل CRISPR

کنترل CRISPR
رویکردهای مبتنی بر نور برای هدایت CRISPR-Cas9 ، ابزار قدرتمند ویرایش ژنوم برنده جایزه نوبل ، وعده افزایش دقت و ویژگی این تکنیک را می دهد-و ممکن است به کاربرد بالینی آن کمک کند.
در اوایل سال 2011 ، دو دانشمند در خیابان های سنگ فرش قدیمی سن خوان ، منطقه تاریخی پایتخت پورتوریکو قدم زدند. این زوج به تازگی توسط یکی از همکاران خود در کنفرانس میکروبیولوژی معرفی شده اند ، به زودی در مورد پروتئین اسرار آمیزی به نام Csn1 وارد گفتگو شدند. این پروتئین به باکتری ها برای دفاع در برابر ویروس ها کمک کرد ، اما نحوه عملکرد آن مشخص نیست. برخی گمان می کردند که مانند قیچی ژنتیکی عمل می کند و DNA ویروسی مهاجم را قطع کرده و تهدید را خنثی می کند. اما هنوز کسی آن را نشان نداده است.
این دو دانشمند - جنیفر دودنا ، مستقر در کالیفرنیا و امانوئل شارپانتیه ، کار در سوئد - به دنبال کشف عملکردهای داخلی Csn1 و نقش آن در سیستم ایمنی بزرگتر باکتری ها بودند. آنها دریافتند که این پروتئین در واقع مواد ژنتیکی خارجی را جدا کرده و ثابت کرده است که می تواند بخشی از یک تکنیک فوق العاده قدرتمند و همه کاره برای برش DNA در هر مکان مورد نظر در ژنوم باشد.
همکاری از راه دور دوودنا و شارپانتیه در Csn1-که امروزه به عنوان Cas9 شناخته می شود-منجر به کشف برنده جایزه نوبل شد که تاثیر آن در بزرگترین پیشرفت های زیست پزشکی تاریخ رقبای خود است. در کنار ابزارهایی مانند تعیین توالی DNA و واکنش زنجیره ای پلیمراز ، بشریت اکنون CRISPR-Cas9 را در اختیار دارد ، یک تکنیک ویرایش ژنوم که به محققان اجازه می دهد DNA ارگانیسم ها را به دلخواه تغییر دهند.
در حالی که سیستم CRISPR -Cas9 قبلاً به نتایج انقلابی دست یافته است ، نحوه کنترل عملکرد آن در محیط های بیولوژیکی و در نهایت بالینی یک پرسش بزرگ باقی مانده است. و به طور فزاینده ای ، محققان از استفاده از نور به عنوان سوئیچ کنترل-برای روشن و خاموش کردن ویرایش ژنوم ، برای کاهش احتمال اثرات خارج از هدف و قرار دادن CRISPR-Cas9 در محل دقیق استفاده می کنند.
"به طور کلی ، ما CRISPR -Cas9 را برای ترمیم یا ویرایش ژن های خاص بدون هیچ گونه کنترل ارائه می دهیم. هنگامی که این درمان را به طور سیستماتیک انجام دهید ، در همه جای بدن پخش می شود. "یوان پینگ ، استاد علوم دارویی در دانشگاه ژجیانگ ، چین می گوید. اما اگر شما مستقیماً به کبد نور بدهید ، ویرایش ژنوم فقط در آنجا اتفاق می افتد. در عصر پزشکی دقیق ، من فکر می کنم که نور می تواند این فرصت را برای ارائه دقت به مراقبت های بهداشتی در آینده فراهم کند. "
نیروگاه ویرایش ژنوم
همانطور که از نامش پیداست ، سیستم CRISPR -Cas9 دارای دو جزء است که در اصل به عنوان بخشی از یک سیستم ایمنی ساده در باکتری E. coli کشف شده است. CRISPR - مخفف کلمه "به طور مرتب تکرارهای کوتاه پالیندرومیک متقاطع" - قطعات کوچکی از مواد ژنتیکی ویروسی را تشکیل می دهد که باکتری در DNA خود برای تشخیص مزاحمان ویروسی جاسازی می کند. Cas9 آنزیمی است که در سیستم برای قطع و غیرفعال کردن DNA در ویروس هایی که به این ترتیب شناسایی می شوند ، استفاده می شود. ("Cas" در Cas9 مخفف "پروتئین مرتبط با CRISPR" است.)
در سیستم باکتریایی ، بخش CRISPR ژنوم ، که حاوی مواد تعبیه شده در DNA باکتری پس از برخورد ویروسی قبلی است ، به یک مولکول RNA بلند و تک رشته ای رونویسی می شود. سپس RNA های کوتاهی موسوم به RNA های CRISPR فعال کننده trans (tracrRNA) ایجاد می شوند که در توالی های تکراری مانند قطعات پازل قرار می گیرند و به آنزیم Cas9 گره خورده اند.
RNA طولانی تر که در اصل از بخش DNA CRISPR رونویسی شده است ، سپس توسط یک آنزیم متفاوت به بخش هایی تقسیم می شود-به اصطلاح RNA های CRISPR (CRRNA)-که حاوی اطلاعات ژنتیکی مورد نیاز برای شناسایی هر ویروس منحصر به فرد کد شده در بخش CRISPR است. هنگامی که یکی از CRRNA های جداگانه در ناحیه ای از DNA ویروسی قرار می گیرد ، که نشان دهنده حمله ویروس ورودی است ، tracrRNA و Cas9 با هم کار می کنند تا DNA ویروسی را شناسایی و خرد کرده و مواد ژنتیکی مهاجم را در مسیر خود متوقف کنند.
دودنا و شارپانتیه با ترکیب CRRNA و tracrRNA در یک مولکول واحد ، که آنها را RNA راهنما نامیدند ، سیستم طبیعی باکتری ها را ساده کردند. این به دانشمندان اجازه داد تا یک RNA راهنما ایجاد کنند که با هر قسمتی از DNA که در آن باید دو رشته ایجاد شود مطابقت داشته باشد-در اصل ، در هر موجودی. برش در هر مکان دلخواه درون ژنوم به این معنی است که حذف ژنهای قدیمی و درج ژنهای جدید را می توان به راحتی انجام داد. (نحوه عملکرد ویرایش CRISPR -Cas9 را در زیر مشاهده کنید.)
فراتر از Cas9: RNA ها و پروتئین های ضد CRISPR
تعداد انگشت شماری از گروه های تحقیقاتی به بررسی کنترل های مبتنی بر نور برای سایر قسمت های سیستم CRISPR-Cas9 پرداخته اند. در سال 2020 ، دیترز و همکارانش روش فتوکیمیایی نوری خود را بر روی جزء RNA راهنمای سیستم اعمال کردند. این تیم دریافتند که قرار گرفتن در معرض اشعه ماوراء بنفش 365 نانومتری باعث ویرایش ژنوم با ویژگی مکانی و زمانی بالا در سلول های پستانداران و جنین گورخرماهی می شود.
در سال 2019 ، آزمایشگاه سین کیینگ تانگ ، استاد علوم داروسازی در دانشگاه پکن ، چین ، یک CRRNA فتوکپی شده را با پیوند دادن آن به یک مولکول ویتامین E طراحی و ساخت که به طور قابل توجهی از برش DNA جلوگیری می کند. پس از چند دقیقه تابش 365 نانومتری ، مولکول ویتامین E و پیوند دهنده عکس به طور کامل از crRNA جدا شده و به فعالیت عادی CRISPR-Cas9 اجازه می دهد.
نیوپک و همکارانش با طی مسیری کمتر متعارف ، توجه خود را به پروتئین های موجود در باکتریوفاژها معطوف کردند که به عنوان عوامل ضد دفاع در برابر سیستم ایمنی باکتری عمل می کنند. آزمایشگاه او پیشگام این روش بینایی زایی منحصر به فرد در سال 2018 بود و به منظور تطبیق پذیری بیشتر و سهولت استفاده ، به اصلاح آن ادامه می دهد.
نیوپک می گوید: "ما در واقع به سیستم های طبیعی فکر می کردیم که فعالیت CRISPR-Cas را مختل یا کنترل می کنند ، و معلوم می شود که یک کلاس بسیار جالب از پروتئین ها به نام anti-CRISPR وجود دارد." "آنچه ما در حال بررسی آن هستیم این است که آیا می توانیم این پروتئین های ضد CRISPR را با نور کنترل کنیم."
آینده کنترل نوری
در حالی که این مطالعات چشم انداز ویرایش ژنوم درمانی را در نظر می گیرند ، اکثر متخصصان در نهایت کنترل نوری CRISPR -Cas9 را بیشترین تأثیر را به عنوان یک ابزار تحقیق می دانند. در حال حاضر ، CRISPR-Cas9 و انواع آن مزایایی نسبت به سایر تکنیک های ویرایش ژنوم برای ایجاد خطوط سلولی و ارگانیسم های اصلاح شده ژنتیکی ، بازجویی عملکرد ژن پویا و سایر برنامه های تحقیقات زیست پزشکی نشان داده اند. کنترل مشروط با نور فقط باید آن افق ها را گسترش دهد.
امکان ارائه ژن درمانی ایمن تر با استفاده از اپتیک دور از ذهن نیست ، اگرچه روشهای ساده تری برای محدود کردن اثرات خارج از هدف در حال آزمایش است که احتمالاً ابتدا به کلینیک می رسد. به عنوان مثال ، چندین نوع مهندسی Cas9 توسعه داده شده است که منجر به افزایش ویژگی و تمایز DNA مورد نظر می شود.
با این حال ، کنترل نوری با موفقیت مدت زمان فعالیت Cas9 را کوتاه می کند ، که باید اثرات خارج از هدف را کاهش دهد. و nanoCRISPR و روشهای دیگر ویرایش غیر اختصاصی را در سایتهایی با بیشترین پتانسیل برای فعالیت خارج از هدف به حداقل رسانده اند. با این وجود ، مطالعات بیشتری برای تعیین اینکه آیا کنترل نوری اثرات خارج از هدف را در سطح کل ژنوم کاهش می دهد یا خیر ، و بر نگرانی های احتمالی ایمنی و عوارض جانبی غلبه می کند.
با این حال ، به نظر می رسد که کنترل مبتنی بر نور به عنوان بخشی از جعبه ابزار CRISPR-Cas9 باقی مانده است. تانگ می گوید: "من به آینده کنترل نوری CRISPR خوشبین هستم." "حداقل ، می تواند یک ابزار قدرتمند در تحقیقات بیولوژیکی باشد. علاوه بر این ، اگر بتوانیم مشکل طول موج تابش نور و بهبود کارایی ویرایش ژن CRISPR را به طور کلی حل کنیم ، می توان در عمل پزشکی از آن استفاده کرد. "
میکروب شناسی پلاسما
از سال 2005 بخش میکروبیولوژی پزشکی و بهداشت بیمارستان بخشی از همکاری پزشکی پلاسما است.
مشارکت در پروژه:
تشخیص میکروبیولوژیکی بیماران ثبت نام شده در مطالعات بالینی
مشاوره و مساعدت در زمینه طراحی و تحقق آزمایشات عقیم سازی از جمله دفع تجهیزات آزمایشگاهی و انواع مختلف باکتریها و قارچها
تخلیه پلاسما DC: فناوری خلا
کاربردهای رزونانس نوری در سنجش و تصویربرداری بیولوژیکی: II. بیوسنسورهای رزونانس حفره
کاربردهای رزونانس نوری در سنجش و تصویربرداری بیولوژیکی: II. بیوسنسورهای رزونانس حفره
بازجویی از فعل و انفعالات اتصال بین پروتئینها ، بخشهای DNA یا RNA و مولکولهای کوچک زیست اختصاصی برای تعداد زیادی از کاربردها در تحقیقات بیولوژیکی و پزشکی از اهمیت اساسی برخوردار است. فناوری ریزآرایه در دهه گذشته برای پرداختن به برنامه هایی که به دنبال اندازه گیری همزمان هزاران یا حتی میلیون ها تعامل الزام آور هستند ، ظهور کرده است. ریزآرایه از یک تکیه گاه جامد یا بستر تشکیل شده است که در سطح بالایی آن لکه های زیادی وجود دارد که هر کدام حاوی نوع متفاوتی از مولکول گیرنده ثابت است. ادامه مطلب ...
کتاب راهنمای فوتونیک برای علوم پزشکی
شبیه سازی FDTD برهم کنش نور با سلولها برای تشخیص و تصویربرداری در نانوبیوفوتونیک نانوذرات پلاسمونیک : ساخت ، خصوصیات نوری و کاربردهای پزشکی. ترانسفکشن با تزریق نوری. پیشرفت در طیف سنجی و تصویربرداری فلورسانس. کاربردهای توموگرافی نوری در تحقیقات زیست پزشکی. فلورسانس تصویربرداری مادام العمر و اندازه گیری برای زیست پزشکی. رامان و CARS میکروسکوپ سلول ها و بافت ها. طیف سنجی رامان از پوست انسان برای تشخیص داخل بدن مواد آنتی اکسیدان کاروتنوئید ارزیابی نور پلاریزه محیط های کدورت پیچیده مانند بافت های بیولوژیکی با استفاده از تجزیه ماتریس مولر. ادامه مطلب ...
تکنیک های مبتنی بر لیزر برای کاربردهای پزشکی
تکنیک های مبتنی بر لیزر برای کاربردهای پزشکی
استفاده از لیزر در ساختار مواد که به توسعه درمان های جدید در زمینه پزشکی زیستی کمک می کند
این کتاب استفاده از لیزر در ساختار مواد برای کاربردهای پزشکی زیستی را بررسی می کند. اصطلاح "زیست پزشکی" حوزه تحقیقات کاربردی را شامل می شود که به توسعه درمان های جدید کمک می کند. برای ترسیم مضامین مختلف ، این کتاب به همراه مطالعات تجربی و تجزیه و تحلیل داده ها ، به چندین فصل تقسیم شده است که شامل اطلاعات پیشینه است. ادامه مطلب ...
تصویربرداری عصبی MRI (fMRI)
محققان از هوش مصنوعی در تحقیقات زیست پزشکی خود استفاده می کنند
تشخیص به موقع بیماری آلزایمر (AD) با استفاده از تجزیه و تحلیل شبکه های مغزی
انحطاط عصبی مرتبط با AD مدت ها قبل از ظهور علائم بالینی آغاز می شود. اطلاعات ارائه شده توسط داده های تصویربرداری عصبی MRI (fMRI) عملکردی ، که می تواند تغییرات در بافت مغز را در مراحل اولیه AD تشخیص دهد ، امکان تشخیص و درمان به موقع را دارد. ادامه مطلب ...
