
Sepanta Laser Spadan
شرکت سپنتا لیزر اسپادان سهامی خاص
Sepanta Laser Spadan
شرکت سپنتا لیزر اسپادان سهامی خاصدستگاه مبتنی بر رنگ روشن و فلورسنت از پوسیدگی دندان جلوگیری می کند
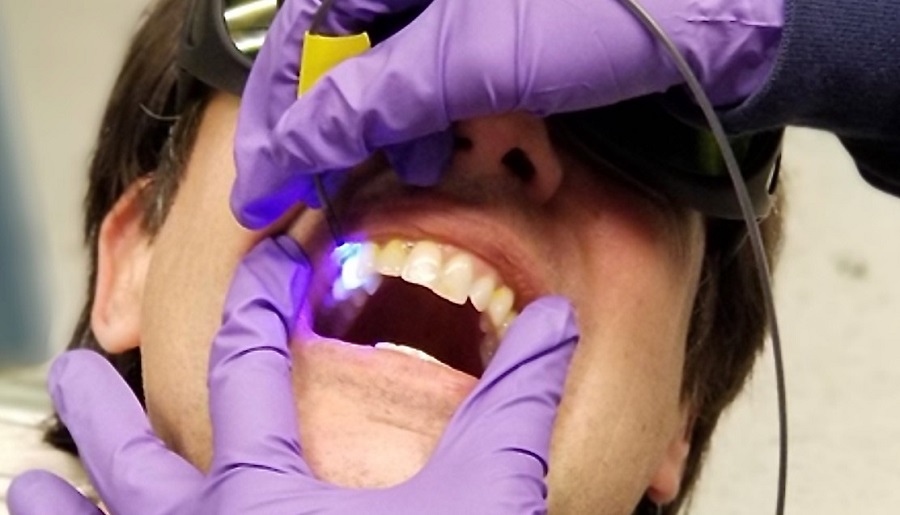
یک دستگاه نوری در حال توسعه در دانشگاه واشنگتن (UW) میتواند با شناسایی دندانهای در معرض خطر قبل از اینکه حفرهها فرصتی برای شروع رشد پیدا کنند، به جلوگیری از پوسیدگی دندان کمک کند. نمونه اولیه که O-pH نام دارد، از یک سیستم نور کم مصرف و یک محلول رنگ فلورسنت تایید شده توسط FDA، سدیم فلورسین، برای اندازه گیری اسیدیته بیوفیلم خوراکی روی مینای دندان و ارائه بازخورد کمی استفاده می کند.
مانوجا شارما، محقق، گفت: پلاک دارای باکتری های زیادی است که در اثر تعامل با قند موجود در غذا، اسید تولید می کنند. این اسید همان چیزی است که باعث خوردگی سطح دندان و در نهایت حفره ها می شود. بنابراین، اگر بتوانیم اطلاعاتی در مورد فعالیت اسیدی دریافت کنیم، میتوانیم ایدهای از نحوه رشد باکتریها در بیوفیلم یا پلاک دندان به دست آوریم.
یک نمونه اولیه ابزار دندانپزشکی جدید UW از یک سیستم نور کم مصرف برای نظارت بر واکنشها با محلول رنگ فلورسنت استفاده میکند تا تشخیص دهد که مینای دندان در کجا بیشتر در معرض خطر اسیدی بودن پلاک است. با حسن نیت از دانشگاه واشنگتن و IEEE Xplore/Creative Commons.
O-pH یک حسگر PH نوری است که از نور در محدوده 420 نانومتر برای تحریک رنگ فلورسین استفاده می کند. نور فلورسنت را با استفاده از فتودیودهای فیلتر شده با فیبر جفت شده جمع آوری می کند. این سیستم نور را از یک LED منتشر می کند که در حین استفاده از رنگ فلورسنت به دندان ها می تابد. یک کاوشگر نور را منتقل می کند و آن را جمع آوری می کند، در حالی که روی سطح دندان شناور است. نور جمعآوریشده به یک سیستم اندازهگیری مرکزی برمیگردد و با استفاده از اطلاعات موجود در نور، سیستم PH هر دندان را نشان میدهد.
O-pH از یک روش سنجش pH نسبت سنجی برای تولید یک قرائت عددی از سطح pH پلاک دندان استفاده می کند. pH را در محدوده 4 تا 7.5 اندازه گیری می کند، محدوده pH معمولی بیوفیلم دندان. تیم UW با استفاده از محلول بافر فلورسین با ضریب همبستگی 0.97، سیستم را به یک pH متر آزمایشگاهی کالیبره کرد. محققان کالیبراسیون را در شرایط آزمایشگاهی با استفاده از محلول بافر متفاوت و دندانهای مصنوعی و کشیده تأیید کردند.
این تیم با اندازه گیری pH روی سطح دندان ها قبل و بعد از شستشوی شکر، این سیستم را روی 30 کودک در دو گروه مختلف (پیش تمیز کردن و بعد از تمیز کردن) آزمایش کردند. دانشجویان دانشکده دندانپزشکی UW اندازه گیری ها را زیر نظر یکی از اعضای هیئت علمی انجام دادند. O-pH تفاوت قابل توجهی در pH بیوفیلم بین گروه های قبل و بعد از تمیز کردن نشان داد. مطالعه بالینی توانایی O-pH را برای تمایز بین بار بیوفیلم کم و زیاد با استفاده از اندازهگیری pH نشان داد.
محققان گفتند که یکی از اشکالات این مطالعه عدم توانایی در اندازه گیری مداوم محل یکسان روی هر دندان در طول هر مرحله از آزمایش است. برای رفع این محدودیت، آن ها O-pH را افزایش می دهند تا توانایی تولید تصاویری را در بر بگیرد که فوراً محل دقیق اسیدیته بالا را به دندانپزشک نشان می دهد، جایی که می تواند حفره جدیدی ایجاد شود. این تیم با استفاده از یک آندوسکوپ فیبری اسکن چند حالته O-pH را از یک دستگاه مبتنی بر نقطه به یک دستگاه مبتنی بر تصویر تبدیل کردند و این نمونه اولیه را روی یک سوژه آزمایش کردند.
شارما گفت که همه باکتری های موجود در پلاک منجر به ایجاد حفره نمی شوند. اندازه گیری اسیدیته محیط بیوفیلم می تواند بدون نیاز به آزمایش انواع خاصی از باکتری های مضر، به دندانپزشکان بفهمد که در مورد نواحی مشکل بالقوه باید بدانند.
پروفسور اریک سیبل انجام آزمایش اسیدیته O-pH را قبل از تمیز کردن دندان های بیمار در نظر می گیرد. او گفت: "دندانپزشک آنها را با محلول رنگ فلورسنت بی مزه شستشو می دهد و سپس دندان های آنها را اسکن اپتیکال می کند تا به دنبال مناطق تولید اسید بالا که در آن مینای دندان در حال تخریب شدن است."
شارما گفت: "ما به نتایج بیشتری نیاز داریم تا نشان دهیم چقدر برای تشخیص موثر است، اما قطعا می تواند به ما در درک کمی از سلامت دهان و دندان شما کمک کند." همچنین میتواند به آموزش بیماران در مورد اثرات قند بر روی ساختار شیمیایی پلاک کمک کند.
روش لکه لیزری جریان خون را در ریز عروق ثبت می کند

محققان دانشگاه ملی سنگاپور یک روش خودهمبستگی لکه های لیزری هم کانونی برای تصویربرداری از جریان پویا در عروق ریز ابداع کردند. این تکنیک بدون برچسب است و تصویربرداری کمی و بیدرنگ از جریان خون در سطح میکروسکوپی را امکانپذیر میکند.
این سیستم دارای بسیاری از ویژگی های یک میکروسکوپ فلورسانس کانفوکال است. مانند میکروسکوپ فلورسانس کانفوکال، می تواند تصاویر جریان با کیفیت بالا و با جزئیات را از نمونه های بافت ضخیم به دست آورد. روش توصیف شده توسط محققان نیازی به برچسب زدن فلورسانس یا هر روش آماده سازی نمونه دیگری ندارد. در عوض، مکانیسم کنتراست ذاتی است، بر اساس تغییرات فاز نوری ناشی از جریان سلولهای خون، که میتواند به نوسانات شدت نور تصادفی تبدیل شود.
هنگامی که یک نمونه بافت با پرتو لیزر روشن می شود، تصاویر به دست آمده به طور کلی دارای نوسانات شدت تصادفی هستند، به اصطلاح لکه های لیزری. راهاندازی تصویربرداری لکهای لیزری کانفوکال در بالای یک میکروسکوپ کانفوکال اسکن خطی اجرا میشود که یک خط روشنایی را روی نمونه تشکیل میدهد. یک دوربین خطی برای گرفتن انتخابی سیگنالهای لکهای که از خط روشن میآیند و به طور مؤثر نور خارج از فوکوس را رد میکند، قرار داده شده است، که یک مشکل جدی است که منجر به کاهش کنتراست و وضوح در تکنیکهای معمولی تصویربرداری لکههای لیزری میشود.
با اسکن سریع خط روشنایی در سراسر سطح نمونه، می توان تصاویر دوبعدی لکه های خام را با سرعت بیش از 200 فریم در ثانیه به دست آورد. تجزیه و تحلیل سری زمانی تصاویر لکه ای پیکسل به پیکسل انجام می شود - استراتژی که وضوح فضایی را در تصاویر پردازش شده حفظ می کند.
همبستگی خودکار و محاسبه کنتراست لکه هر دو حالت های رایج تجزیه و تحلیل هستند که پارامترهای مشتق شده از لکه را به سرعت جریان خون محلی مرتبط می کنند.
با این حال، ترکیب میکروسکوپ کانفوکال با تجزیه و تحلیل لکههای مبتنی بر همبستگی خودکار، به نام تصویربرداری خودهمبستگی لکهای لیزری اسکن خطی (LSAI)، مزایای قابلتوجهی دارد. آزمایشهای تصویربرداری با حیوانات کوچک، محققان را قادر ساخت تا نشان دهند که LSAI میتواند سرعت جریان محلی را در پیکسلهای منفرد، که بهطور قابلتوجهی کوچکتر از قطر معمولی مویرگها هستند، کمی کند. علاوه بر این، LSAI به اندازه کافی سریع است تا تغییرات سرعت جریان ویدئویی را در همان سطح میکروسکوپی ثبت کند.
یک کاربرد فوری و مهم تصویربرداری لکهدار لیزری کانفوکال، نقشهبرداری و تعیین کمیت جریان خون پویا در رگهای کوچک است که کوچکترین رگهای خونی در بافتهای اندام، از جمله شریانهای انتهایی، متارتریولها، مویرگها و ونولها هستند. تجزیه و تحلیل گردش خون در ریز عروق یا میکروسیرکولاسیون، در تجزیه و تحلیل و درک پاتوفیزیولوژی و پاتوژنز طیف گسترده ای از بیماری های انسانی اساسی است.
ابزارهای آزمایشی با وضوح زمانی و تفکیک مکانی به اندازه کافی بالا برای تجسم درون تنی و مهمتر از آن، اندازهگیری کمی نقشههای جریان خون وابسته به زمان در عروق کوچک برای تحقیقات بالینی و بالینی بیشتر مطلوب هستند.
محققان بر این باورند که این دستگاه می تواند به یک ابزار تصویربرداری استاندارد در تحقیقات میکروسیرکولاسیون و همچنین برای تشخیص بالینی تبدیل شود.
هدف گیری نوری سلول های سرطانی، بافت سالم را بدون آسیب می گذارد
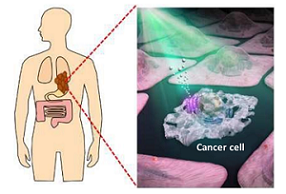
یک گروه تحقیقاتی در دانشگاه اوکایاما در حال کار بر روی روشی برای جلوگیری از آسیب سلول های سالم در طول درمان سرطان هستند. این گروه در حال توسعه یک روش القای نور برای تحریک آپوپتوز سلولی تنها در سلولهای هدف هستند، با استفاده از پروتئین فعال شده با نور به جای مواد شیمیایی.
در حالی که دارو درمانی به عنوان ابزار اصلی درمان سرطان باقی می ماند، بسیاری از داروها یک مشکل مشترک دارند: آنها نه تنها بر روی سلول های سرطانی، بلکه روی سلول های سالم اطراف نیز اثر می گذارند و باعث واکنش های نامطلوب ناخواسته می شوند.
چندین روش درمانی وجود دارد که از نور برای از بین بردن سرطان استفاده می کنند. به عنوان مثال، فوتوایمونوتراپی یک فرم مولکولی هدفمند از فتوتراپی است که درمان فتودینامیک تومور را با ایمونوتراپی ترکیب می کند تا سلول های سرطانی را از بین ببرد.
پروفسور یوکی سودو گفت: "این روش ها از مواد شیمیایی استفاده می کنند و با تکیه بر آنزیم های فعال یا گرما باعث نکروز فیزیکی می شوند." بنابراین، ما نمیتوانیم واکنشهای نامطلوب را هر چقدر هم که آنها را بهبود بخشیم، حذف کنیم.»
سودو و تیمش به جای استفاده از نکروز برای از بین بردن سلولهای سرطانی، یک روش نوری برای تنظیم مرگ سلولی آپوپتوز ایجاد کردند - فرآیندی که طی آن سلولهای ناخواسته به طور فعال کشته میشوند تا ارگانیسم زنده بماند. محققان با کنترل pH درون سلولی با پروتئین های پمپ پروتون جاذب نور از خانواده رودوپسین به آپوپتوز رسیدند.
سودو گفت: «ما فکر میکردیم که اگر بتوانیم آپوپتوز را در سلولهای سرطانی هدف با استفاده از پروتئینها به جای مواد شیمیایی القا کنیم، میتوانیم به پیشرفتی در درمان سرطان بدون عوارض جانبی همراه کمک کنیم.»
به عنوان بخشی از یک رویکرد نوری برای درمان سرطان که توسط تیمی در دانشگاه اوکایاما توسعه یافته است، AR3، یک پروتئین فعال شده با نور از خانواده رودوپسین، در داخل سلول های سرطانی سنتز می شود و سپس نور اعمال می شود و آپوپتوز سلولی را القا می کند. با حسن نیت از دانشگاه اوکایاما و JST.
محققان بر روی آرکائرودوپسین-3 (AR3)، یک پروتئین جاذب نور از دسته رودوپسین تمرکز کردند که توانایی پمپ کردن یون های هیدروژن را به بیرون از سلول نشان داده است. با کاهش غلظت یون هیدروژن سلول، سلول قلیایی تر می شود. و قلیایی شدن سلول می تواند باعث آپوپتوز شود.
بر اساس این دانش، گروه تحقیقاتی شروع به آزمایش سلولها کردند تا ببینند آیا میتوان آنها را با استفاده از AR3 برای القای آپوپتوز به اندازه کافی قلیایی ساخت. محققان AR3 را در سلول های مشتق از سرطان انسان سنتز کردند و سپس سلول ها را در معرض نور سبز با طول موج تقریبی 550 نانومتر قرار دادند.
انقباض ناشی از قلیایی شدن سلول های HeLa انسانی که در pH 9.0 کشت شده بودند به طور قابل توجهی توسط AR3 فعال شده با نور تسریع شد. محققان مشاهده کردند که بیشتر سلول ها در عرض سه ساعت تحت آپوپتوز قرار گرفتند.
محقق Shin Nakao، یکی از دانشجویان سودو، آزمایشی موازی انجام داد که در آن شرایط pH اعمال شده روی سلول ها در pH فیزیولوژیکی خنثی 7.4 بود. یک تجزیه و تحلیل بیوشیمیایی نشان داد که قلیایی شدن داخل سلولی ناشی از AR3 مسیر سیگنالینگ آپوپتوز میتوکندری را تحریک می کند که منجر به مرگ سلولی همراه با تغییرات مورفولوژیکی می شود.
PH اندازه گیری غلظت یون هیدروژن در یک محیط است و به عنوان شاخص اسیدیته، خنثی بودن و قلیاییت استفاده می شود. سودو گفت: "من فکر می کردم که آزمایش رویکرد ما قطعا نمی تواند در شرایط خنثی انجام شود." سلولها وقتی در محلول قلیایی خیسانده میشوند میمیرند و من فکر کردم که آیا میتوان این فرآیند را با استفاده از AR3 تسریع کرد. بنابراین، من فقط در pH 9 (قلیایی) آزمایش کردم. با این حال، دانشآموز آزمایشی را با pH 7 (خنثی)، یعنی شرایطی که معمولاً در بدن انسان رخ میدهد، انجام داد.
در PH خنثی، مشاهده نتایج در مدت زمان طولانیتری ضروری بود، اما آزمایش در نهایت موفق شد. سودو گفت: "اگر استراتژی ما در pH خنثی عمل کند، می توان از آن برای توسعه درمان استفاده کرد."
ناکائو افزود: «من میخواستم شرایط را برای بیماران قابل اجرا کنم، کاری که در pH 9 قابل انجام نیست. "بنابراین، من رویکردمان را در pH 7 امتحان کردم. این اتفاق افتاد، بنابراین خوشحالم که آن را امتحان کردم."
سپس محققان رویکرد خود را در آزمایشهای in vivo آزمایش کردند. آنها AR3 را روی نورون های حسی C. elegans سنتز کردند و فقط سلول های عصبی را هدف قرار دادند. هنگامی که بدن C. elegans در معرض نور سبز قرار گرفت، تنها نورونهایی که AR3 را سنتز میکنند، واکنش حسی کاهشیافتهای به مواد شیمیایی نشان دادند. به نظر میرسد که یونهای هیدروژن توسط AR3 از این نورونها پمپ شده و باعث قلیایی شدن سلولها و مرگ آنها شده است.
بر اساس این نتایج، محققان به این نتیجه رسیدند که AR3 میتواند باعث آپوپتوز در سلولهای هدف در هنگام قرار گرفتن در معرض نور شود.
محققان رویکرد خود را در قلیاییسازی سلولها با روشی که واکسن پیامرسان RNA (mRNA) برای COVID-19 کار میکند، مقایسه میکنند. همانطور که mRNA برای سنتز پروتئین های لازم به سلول ها تزریق می شود، ژن های AR3 باید به سلول های سرطانی وارد شوند تا سلول ها بتوانند AR3 را سنتز کنند. نشانگرهای ژنتیکی را می توان تنها برای سنتز AR3 در سلول های هدف استفاده کرد.
سودو گفت: "با استفاده از روش آپوپتوز سلولی القا شده توسط نور، که در آن AR3 فقط در سلول های سرطانی انسان سنتز می شود، می توان سلول های بیمار را بدون ایجاد واکنش های نامطلوب در سلول های سالم اطراف از بین برد."
این گروه گفت که قصد دارد روی بافت پستانداران آزمایش کند. رویکرد محققین به آپوپتوز ناشی از عکس پتانسیل بهعنوان یک ابزار اپتوژنتیک برای از بین بردن انتخابی سلولهای هدف با وضوح فضایی و زمانی بالا دارد.
برخی از مردم ممکن است فکر کنند که چون رویکرد ما سرطان را با نور از بین میبرد، مانند روشهای قبلی است. با این حال، استراتژی ما حول آپوپتوز به جای نکروز متمرکز است و بنابراین اساساً متفاوت است. سودو گفت: رویکرد ما میتواند به روشهای درمانی کاملاً جدید منجر شود.
فرامواد تراهرتز قابل برنامه ریزی با حافظه غیر فرار
خلاصه
تعدیل کننده های نور فضایی (SLMs) توانایی قدرتمندی در کنترل امواج الکترومغناطیسی از خود نشان می دهند. مشخص شده است که آنها کاربردهای متعددی در فرکانس های تراهرتز (THz) دارند، از جمله ارتباطات بی سیم، هولوگرافی دیجیتال و تصویربرداری فشرده. با این حال، توسعه به سمت SLM THz در مقیاس بزرگ، چند سطحی و چند عملکردی با چالشهای فنی مواجه است. در اینجا، یک متاماده THz قابل برنامه ریزی الکتریکی متشکل از آرایه ای 8×8 پیکسل ارائه شده است که در آن ماده تغییر فاز دی اکسید وانادیم (VO2) تعبیه شده است. پس از سرکوب موفقیت آمیز تداخل از پیکسل های مجاور، موج THz را می توان به روشی قابل برنامه ریزی مدوله کرد. سرعت سوئیچینگ هر پیکسل به ترتیب 1 کیلوهرتز است. به طور خاص، با استفاده از اثر هیسترزیس VO2، اثر حافظه نشان داده میشود. دامنه THz هر پیکسل را می توان با تک تک پالس های جریان نوشت و پاک کرد. علاوه بر این، تصاویر چند حالته THz را می توان تولید و ذخیره کرد. این متاماده قابل برنامه ریزی با عملکرد حافظه می تواند به سایر باندهای فرکانسی گسترش یابد و مسیری را برای پردازش اطلاعات الکترومغناطیسی باز می کند.
فرامواد تراهرتز قابل برنامه ریزی با حافظه غیر فرار
متاماده تراهرتز با عملکرد حافظه. هر پیکسل با سرکوب تداخل حرارتی آدرسپذیر است و سرعت مدولاسیون 1 کیلوهرتز به دست میآید. حالت آن امکان نوشتن، خواندن و پاک شدن با یک پالس الکتریکی را فراهم می کند. بنابراین، ذخیره سازی غیر فرار تصاویر تراهرتز چند حالته نشان داده شده است.
سوئیچینگ کیو گرافن دینامیک تک کاناله و دو کاناله در یک لیزر موجبر کانال کانالی از نوع پرتو
سوئیچینگ کیو گرافن دینامیک تک کاناله و دو کاناله در یک لیزر موجبر کانال کانالی از نوع پرتو

عملکرد سوئیچ کیو دینامیکی یک لیزر موجبر کانال کانالی از نوع پرتو اسپلیتر یکپارچه با گرافن را ارائه می دهند. سوئیچینگ Q تک کاناله و دو کاناله کنترل شده را می توان بر اساس تحریک انتخابی کانال مورد نظر با نسبت تقسیم توان به طور گسترده تنظیم کرد. به طور خاص، سوئیچینگ دو کاناله Q با یک منبع پمپاژ واحد، یک قطار پالس هیبریدی با دو حالت سوئیچ Q جداگانه به طور همزمان ایجاد می کند.
کتابچه راهنمای هوش مصنوعی در بهداشت و درمان

معرفی
هوش مصنوعی (AI) بسیاری از جنبه های فعالیت های روزانه ما را متحول کرده است. سلامت و رفاه انسانها به عنوان یکی از حوزههای کلیدی است که در آن هوش مصنوعی به پیشرفتهای قابل توجهی دست یافته است، در زمان، هزینهها و به طور بالقوه زندگی صرفهجویی میکند، و همچنین انعطافپذیری اقتصادی را تقویت میکند، به ویژه در محیطهای همهگیر COVID-19.
این کتاب دنباله ای از کتاب راهنمای هوش مصنوعی در مراقبت های بهداشتی است. جلد اول این کتابچه به ارائه پیشرفتها و کاربردهای متدولوژیهای هوش مصنوعی در چندین زمینه خاص، یعنی پردازش سیگنال، تصویر، و ویدئو و همچنین تجزیه و تحلیل اطلاعات و دادهها اختصاص دارد. در این جلد دوم کتاب، چالشهای عملی عمومی و چشماندازهای آینده روشهای هوش مصنوعی مربوط به مراقبتهای بهداشتی و حوزههای مرتبط به ترتیب در بخش 1 و بخش 2 ارائه شدهاند.
پیشبینی میشود که مطالعات انتخابشده دیدگاهی کلی در مورد مسائل، چالشها و فرصتها در طراحی، توسعه و پیادهسازی ابزارها و راهحلهای مبتنی بر هوش مصنوعی در بخش مراقبتهای بهداشتی به خوانندگان ارائه میدهد و مزایایی را برای تغییر و ارتقای سلامت و رفاه به ارمغان میآورد. توسعه انسان ها
موسسه تحقیقات و نوآوری سیستم های هوشمند دانشگاه دیکین ورن پوندز استرالیا
2. کالج علوم و مهندسی اطلاعات دانشگاه ریتسومیکان شیگا ژاپن
3. رویال آدلاید HospitalAdelaide استرالیا
4. موسسه قلب و عروق آوانتی ناگپور هند
5.KES InternationalShoreham-by-SeaUK
روندها و چالش های آینده تصویربرداری مولکولی و نوآوری هوش مصنوعی

روندها و چالش های آینده تصویربرداری مولکولی و نوآوری هوش مصنوعی
معرفی
این مجلد، مجموعه مقالات کنفرانس FASMI 2020 را که در بیمارستان عمومی کهنه سربازان تایپه در تاریخ 20 تا 22 نوامبر 2020 برگزار شد، ارائه میکند. این کتاب مشارکتهایی را در مورد تمام جنبههای تصویربرداری مولکولی که توسط دانشمندان و محققان برجسته دانشگاهی کشف شده است، ارائه میکند. همچنین یک درمان بینرشتهای برتر از نوآوریها، روند و نگرانیهای اخیر و همچنین چالشها و راهحلهای عملی در تصویربرداری مولکولی ارائه میکند و بر هوش مصنوعی اعمال شده در دادههای تصویربرداری تأکید میکند.
FASMI نشست سالانه فدراسیون انجمن های آسیایی برای تصویربرداری مولکولی است
1. بخش مهندسی برق دانشگاه مسیحی چانگ یوان (CYCU) تائویوان تایوان
2. بخش پزشکی هسته ای و گروه تصویربرداری زیست پزشکی و علوم رادیولوژی (BIRS) بیمارستان عمومی چنگ هسین و دانشگاه ملی یانگ مینگ چیائو تونگ (NYCU) تایپه تایوان
3. بخش تصویربرداری زیست پزشکی و علوم رادیولوژی (BIRS) دانشگاه ملی یانگ مینگ چیائو تونگ (NYCU) تایپه تایوان
مجله بیوفوتونیک
ادغام جدیدی از تصویربرداری چند طیفی شبکیه (MSI)، اکسیمتری شبکیه، و تصویربرداری کنتراست لکه لیزری (LSCI) برای تصویربرداری عملکردی رگهای خونی شبکیه ارائه شده است که به طور بالقوه میتواند به تشخیص زودهنگام یا نظارت بر تغییرات عملکردی اجازه دهد. این فناوری می تواند به سرعت تصاویر ساختاری MSI، اکسیمتری شبکیه و اطلاعات جریان خون LSCI را در یک گردش کار بالینی ساده به دست آورد. نتایج حاصل از چندین روش را می توان برای ارائه اطلاعات ساختاری-عملکردی ترکیب کرد.